题目内容
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) △H1=akJ·mol-1
2Cu+(aq) △H1=akJ·mol-1
Cl-(aq)+Cu+(aq)![]() CuCl(s) △H2=bkJ·mol-1
CuCl(s) △H2=bkJ·mol-1
实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )
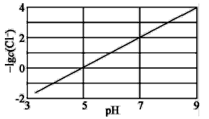
A.增加铜单质的量,有利于Cl-的去除
B.溶液pH越大,Ksp(CuCl)增大
C.反应达到平衡后,增大c(Cu2+),c(Cl-)减小
D.![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl-(aq)
Cu2+(aq)+Cl-(aq)![]() CuCl(s)的△H=(a+2b)kJ·mol-1
CuCl(s)的△H=(a+2b)kJ·mol-1
【答案】C
【解析】
A.铜单质为固体,其用量对化学反应速率和化学平衡没有影响,反应Cu(s)+Cu2+(aq)![]() 2Cu+(aq)的反应效果取决于Cu2+的浓度,与铜单质的量无关,故增加铜单质的量,对Cl-的去除效果没有影响,A选项错误;
2Cu+(aq)的反应效果取决于Cu2+的浓度,与铜单质的量无关,故增加铜单质的量,对Cl-的去除效果没有影响,A选项错误;
B.Ksp(CuCl)只与温度有关,与溶液pH无关,B选项错误;
C.根据Cu(s)+Cu2+(aq)![]() 2Cu+(aq),增大c(Cu2+),平衡正向移动,使得c(Cu+)增大,促进Cl-(aq)+Cu+(aq)
2Cu+(aq),增大c(Cu2+),平衡正向移动,使得c(Cu+)增大,促进Cl-(aq)+Cu+(aq)![]() CuCl(s)右移,c(Cl-)减小,C选项正确;
CuCl(s)右移,c(Cl-)减小,C选项正确;
D.①Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1,②Cl-(aq)+Cu+(aq)
2Cu+(aq) ΔH1=a kJ·mol-1,②Cl-(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1,根据盖斯定律,将①×
CuCl(s) ΔH2=b kJ·mol-1,根据盖斯定律,将①×![]() +②得:1/2Cu(s)+1/2Cu2+(aq)+Cl-(aq)
+②得:1/2Cu(s)+1/2Cu2+(aq)+Cl-(aq)![]() CuCl(s)的ΔH=(
CuCl(s)的ΔH=(![]() +b) kJ·mol-1,D选项错误;
+b) kJ·mol-1,D选项错误;
答案选C。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
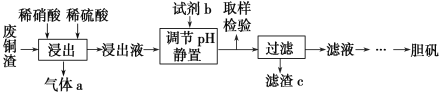
已知生成氢氧化物沉淀的pH如下表所示:
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀 | 4.2 | 6.5 | 1.5 |
完全沉淀 | 6.7 | 9.7 | 3.7 |
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:________________。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是__________________________。
(3)试剂b是____________,滤渣c是______________(均写化学式)。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2===2NO2、 __________________。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式:________________。
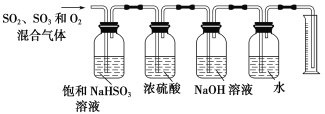
(6)某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:______________。