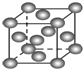
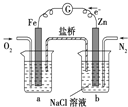
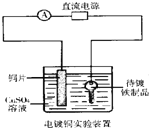
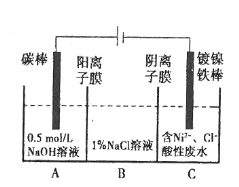
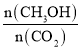��Ŀ����
����Ŀ��CO2����Դ����������Ч����CO2�ŷţ��������̼��Դ��
��3��CO2������ϳɶ�������һ��CO2ת�����������������Ҫ�������з�Ӧ��
��Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H =41.2 kJ��mol1
CO(g)+H2O(g) ��H =41.2 kJ��mol1
��Ӧ��2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ��H =��122.5 kJ��mol1
CH3OCH3(g)+3H2O(g) ��H =��122.5 kJ��mol1
�ں�ѹ��CO2��H2����ʼ��һ���������£�CO2ƽ��ת���ʺ�ƽ��ʱCH3OCH3��ѡ�������¶ȵı仯��ͼ�����У�CH3OCH3��ѡ����=![]() ��100��
��100��
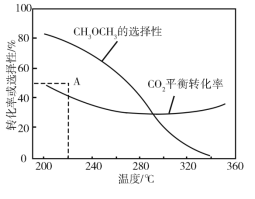
���¶ȸ���300 �棬CO2ƽ��ת�������¶����߶�������ԭ����________��
��220 ��ʱ���ڴ���������CO2��H2��Ӧһ��ʱ����CH3OCH3��ѡ����Ϊ48%��ͼ��A�㣩�����ı䷴Ӧʱ����¶ȣ�һ�������CH3OCH3ѡ���ԵĴ�ʩ��________��
���𰸡���Ӧ��Ħ�H��0����Ӧ��Ħ�H��0���¶�����ʹCO2ת��ΪCO��ƽ��ת����������ʹCO2ת��ΪCH3OCH3��ƽ��ת�����½������������ȳ����½����� ����ѹǿ��ʹ�öԷ�Ӧ������Ը��ߵĴ���
��������
(3)���¶ȸ���300�棬CO2ƽ��ת�������¶����߶�������ԭ���ǣ���Ӧ�����H��0����Ӧ�����H��0�����·�Ӧ��������У���Ӧ��������У�
�ڲ��ı䷴Ӧʱ����¶ȣ�һ�������CH3OCH3ѡ���Ե����������CH3OCH3��ѡ����=![]() ��100%������ƽ��������ж�����ѡ��������
��100%������ƽ��������ж�����ѡ��������
���¶ȸ���300�棬CO2ƽ��ת�������¶����߶�������ԭ���ǣ���Ӧ�����H��0����Ӧ�����H��0���¶�����ʹCO2ת��ΪCO��ƽ��ת����������ʹCO2ת��ΪCH3OCH3��ƽ��ת�����½������������ȳ����½����ȣ�
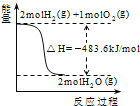
��2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)��H=-122.5kJmol-1�����CH3OCH3��ѡ����=![]() ��100%������ƽ��������ж��������ʵ�����������̼���ʵ�����С��������ѡ���������ı䷴Ӧʱ����¶ȣ�һ�������CH3OCH3ѡ���ԵĴ�ʩ������ѹǿƽ��������У�ʹ�öԷ�Ӧ������Ը��ߵĴ�������������ѵ�ѡ���ԡ�
��100%������ƽ��������ж��������ʵ�����������̼���ʵ�����С��������ѡ���������ı䷴Ӧʱ����¶ȣ�һ�������CH3OCH3ѡ���ԵĴ�ʩ������ѹǿƽ��������У�ʹ�öԷ�Ӧ������Ը��ߵĴ�������������ѵ�ѡ���ԡ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����1�����ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ���ʱ�������㡣��֪��
C(s��ʯī)��O2(g)===CO2(g) ��H1����393.5 kJ��mol��1
2H2(g)��O2(g)===2H2O(l) ��H2����571.6 kJ��mol��1
2C2H2(g)��5O2(g)===4CO2(g)��2H2O(l) ��H3����2599 kJ��mol��1
���ݸ�˹���ɣ�д��298 Kʱ��C(s��ʯī)��H2(g)����1 mol C2H2(g)�Ȼ�ѧ����ʽ��__________________________________________��
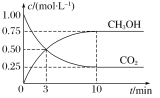
��2����1.0 L����ܱ������г���4.0 mol A(g)��4.0 mol B(g)����һ���¶��½��з�Ӧ��A(g)+B(g)C(g) ��H����ò�ͬʱ�̸����������ʵ����ʵ������±�:
ʱ��/min | 0 | 10 | 20 | 30 | 40 |
n(A)/mol | 4.0 | 2.5 | 1.5 | n2 | n3 |
n(C)/mol | 0 | 1.5 | n1 | 3 | 3 |
�ش��������⣺
�������¶ȵ����ߣ��÷�Ӧ�Ļ�ѧƽ�ⳣ����С������H___(����>����<������=��)0����Ӧ����ʼ��30min��A��ƽ����Ӧ������_______�����¶��£�������Ӧ�Ļ�ѧƽ�ⳣ��Ϊ____��
������ѡ������˵���÷�Ӧ��һ���¶Ⱥͺ��������´ﵽƽ��״̬����________��
A. ��Ӧ���ʣ�vA(��) =vC(��) B. A��������C���������
C. B��ת���ʲ��ٸı� D. �ܶȲ��ٸı�
��3������ӦC(g)A(g)+B(g)����ʱ�����ϡ�ͼ�X����(�����뷴Ӧ)����C��ƽ��ת������ѹǿ��X�����ʵ����Ĺ�ϵ��ͼ��ʾ��
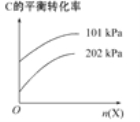
��������������ʱ������X�����ʵ�����C��ƽ��ת���ʽ�________(��������������С������������)����ԭ����______________________________��