题目内容
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
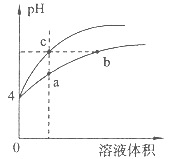
A. a、c两点溶液的导电能力相同
B. b点溶液中c(H+)+c(NH3·H2O)=c(OH-)
C. a、b、c三点溶液中水的电离程度a>b>c
D. 用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc
【答案】C
【解析】试题分析:氯化氢为强电解质,溶于水全部电离,溶液中的氢离子主要是盐酸电离出来的;氯化铵为强酸弱碱盐,氢离子来自铵离子的水解,水解是微弱的,pH相同的盐酸和氯化铵溶液,氯化铵的浓度远大于盐酸的浓度;体积和pH都相同的盐酸和氯化铵溶液加水稀释的过程中,盐酸不能继续电离,盐酸中氢离子浓度变化大;氯化铵溶液中铵离子的水解平衡正向移动,溶液中氢离子浓度变化小,所以含c点的曲线pH变化是盐酸的,含a、b点的曲线pH变化是氯化铵溶液的。A、溶液的导电能力取决于溶液中自由移动离子的浓度,起始氯化铵的浓度远大于盐酸的浓度,稀释相同的倍数还是氯化铵的浓度远大于盐酸的浓度,故导电能力:a点大于c点,错误;B、根据质子守恒知,b点溶液中c(OH-)+c(NH3H2O)=c(H+),错误;C、盐酸电离出的氢离子浓度抑制水的电离,所以c点溶液中水的电离程度最小;水解促进水的电离,由于氯化铵溶液中的氢离子浓度来自于铵根离子水解生成的氢离子,氢离子浓度越大,说明水解程度越大,水的电离程度越大,a点的pH<b点的pH,说明a点氢离子大于b点氢离子,a、b二点溶液水的电离程度:a>b,综上所述a、b、c三点溶液水的电离程度a>b>c,正确; D、用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb>Vc,错误。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目