题目内容
【题目】A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的ⅥB族,F的基态原子中有4个未成对电子。
(1)A元素单质的结构式为___________;B元素原子中的未成对电子数为_______________________。
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是______;A与B形成的AB2-的空间构型为___________________________。
(3)A、B、C三种元素的第一电离能从大到小的顺序为_______________(用元素符号表示)。
(4)基态F3+的核外电子排布式是_____________________;F3+与SCN-络合得到多种配合物,其中配位数为5的配合物的化学式为__________________;化合物FD3是棕色固体、易潮解,100℃左右时升华,FD3的晶体类型是__________________________。
(5)铁在不同温度范围有不同的晶体结构。室温下铁是简单立方,称为α铁(α-Fe)。当温度升高到912℃,α铁转变为面心立方,称为γ铁(γ-Fe)。当温度继续升高到1394 ℃,γ铁转变为体心立方。称为δ铁(δ-Fe)。

①γ铁晶体中铁原子配位数是____________________。
②δ铁晶体密度为dg·cm-3,则其晶胞参数(边长)为__________cm(阿伏加德罗常数用NA表示)。
【答案】 N≡N 2 sp3 V形(或:平面三角型) N>O>Si 1s22s22p63s23p63d5(或:[Ar]3d5) K2Fe(SCN)5 分子晶体 12 ![]()
【解析】分析:A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,则A为N,B元素是地壳中含量最高的元素,为O,C元素的最高化合价和最低化合价的代数和等于0,为第四主族元素,结合原子序数大小可知为Si,D元素的单质可用于自来水消毒杀菌,则D为Cl,E元素位于周期表的ⅥB族,则E为Cr,F的基态原子中有4个未成对电子,则F为Fe,结合原子结构特点及元素性质解答。
详解:依据上述分析可知A、B、C、D、E、F元素依次为:N,O,Si,Cl,Cr,Fe。则
(1)A元素单质为氮气,氮气分子内存在1个氮氮三键,结构式为N≡N;B元素为氧元素,O原子中的未成对电子数有2个;
(2)A2H4分子为N2H4,N2H4分子中氮原子的价层电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3,A与B形成的NO2-离子中孤对电子数为:(6-2×2)/2=1,因此分子空间构型是V型;
(3)同周期自左而右元素第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C,同一主族从上到下第一电离能逐渐增大,则第一电离能:C>Si,则N、O、Si的第一电离能大小为:N>O>Si;
(4)Fe3+的3d轨道含有5个电子,则铁离子的核外电子排布式为1s22s22p63s23p63d5(或[Ar]3d5),FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是K2Fe(SCN)5;化合物FD3即FeCl3是棕色固体、易潮解、100℃左右时升华,熔沸点低,属于分子晶体;
(5)①γ铁晶体中与顶点铁原子最近的位于面心处,因此铁原子配位数是12。
②δ铁晶体含有的铁原子个数是8×1/2+1=2,密度为dg·cm-3,则![]() ,因此其晶胞参数(边长)为
,因此其晶胞参数(边长)为![]() cm(阿伏加德罗常数用NA表示)。
cm(阿伏加德罗常数用NA表示)。

【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)用元素代号标出它们在元素周期表中对应的位置(以下为周期表的一部分)。
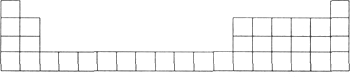
(2)B元素处于周期表中第_______周期第________族。
(3)B的最高价氧化物对应的水化物与C的最高价氧化物对应的水化物反应的离子方程式为_______________。
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是__________(填化学式)。
(5)C、E形成的化合物有__________(填化学式)