题目内容
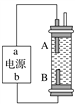
【题目】为了减少钢管因锈蚀造成的损失,某城市拟用如图方法保护埋在酸性土壤中的钢管。下列有关说法错误的是( )

A. 在潮湿的酸性土壤中钢管主要发生析氢腐蚀
B. 在潮湿的酸性土壤中金属棒M将电子通过导线流向钢管
C. 在潮湿的酸性士壤中H+向金属棒M移动,抑制H+与铁的反应
D. 该方法称为牺牲阳极的阴极保护法
【答案】C
【解析】分析:根据图示可知,为了减少钢管的损失,金属棒M、钢管应在酸性土壤中形成原电池,其中金属M做负极,钢管做正极被保护,据此分析。
详解:A、在酸性环境下,钢铁发生析氢腐蚀,A正确;
B、为了减少钢管的损失,金属棒M、钢管应在酸性土壤中形成原电池,其中金属M做负极,失去电子,失去的电子通过导线流向钢管,钢管做正极被保护,B正确;
C、在潮湿的酸性土壤中,存在大量氢离子,氢离子移动到正极上得电子被还原,即移动到钢管上得电子,故能抑制氢离子与铁的反应,C错误;
D、该方法是原电池原理,因此该方法称为牺牲阳极的阴极保护法,D正确。答案选C。

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目