题目内容
6.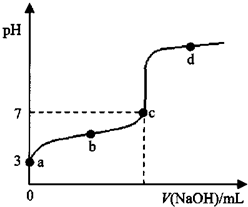 常温下,向20mL 0.1mol•L-1 CH3COOH溶液中加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下,向20mL 0.1mol•L-1 CH3COOH溶液中加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a和b之间的溶液中只存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | b与c之间的溶液中不存在:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| C. | c点时,V(NaOH溶液)<20mL,且c(CH3COO-)=c(Na+) | |
| D. | a、b、c点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$均相等 |
分析 A.a和b之间当NaOH量很少时,可能存在c(Na+)<c(H+);
B.根据图知,b与c之间的NaOH溶液体积大于10mL,溶液呈酸性,混合溶液中n(CH3COONa)≥n(CH3COOH),但醋酸电离程度较小;
C.醋酸钠溶液呈碱性,要使混合溶液呈中性,则醋酸的物质的量应该稍微大小,中性溶液中存在c(H+)=c(OH-),根据电荷守恒判断c(CH3COO-)、c(Na+)相对大小;
D.弱电解质电离平衡常数只与温度有关.
解答 解:A.a和b之间当NaOH量很少时,醋酸电离导致溶液中可能存在c(Na+)<c(H+),故A错误;
B.根据图知,b与c之间的NaOH溶液体积大于10mL,溶液呈酸性,混合溶液中n(CH3COONa)≥n(CH3COOH),但醋酸电离程度较小,所以不可能存在c(H+)>c(Na+),故B正确;
C.醋酸钠溶液呈碱性,要使混合溶液呈中性,则醋酸的物质的量应该稍微大小,所以V(NaOH溶液)<20mL,中性溶液中存在c(H+)=c(OH-),根据电荷守恒得c(CH3COO-)=c(Na+),故C正确;
D.弱电解质电离平衡常数只与温度有关,温度不变电离平衡常数不变,所以a、b、c点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$均相等,故D正确;
故选A.
点评 本题考查酸碱混合溶液定性判断,明确混合溶液中的溶质及其性质、溶液酸碱性是解本题关键,易错选项是D,注意电离平衡常数只与温度有关,与溶液浓度无关.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
16.下表中各组物质不能实现如图转化的是:( )


| A. | AlCl3 Al Al(OH)3 | B. | AlCl3 Al(OH)3 NaAlO2 | ||
| C. | CO2 NaHCO3 Na2CO3 | D. | CO2 (NH4)2CO3 NH3 |
14.下列反应不可能在有机物中引入卤素原子的是( )
| A. | 取代反应 | B. | 加成反应 | C. | 消去反应 | D. | 氧化反应 |
1.设NA表示阿伏伽德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,48g O3含有的氧原子数为3NA | |
| B. | 17g的OH-离子中含有的电子数为0.1NA | |
| C. | 常温常压下,11.2L氧气中所含有的原子数为NA | |
| D. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA |
15.25℃时,在10mL浓度均为0.1mol•L-1的NaOH和NH3•H2O混合溶液中滴加0.1mol•L-1盐酸,下列有关溶液中粒子浓度关系正确的是( )
| A. | 未加盐酸时:c(OH-)>c(Na+)=c(NH3•H2O) | B. | 加入10mL盐酸时:c(NH4+)+c(H+)=c(OH-) | ||
| C. | 加入盐酸至溶液pH=7时:c(Cl-)=c(Na+) | D. | 加入20mL盐酸时:c(Cl-)=c(NH4+)+c(Na+) |
11.下列叙述正确的是( )
| A. | 分子中一定含有化学键 | |
| B. | 共价化合物一定不含有离子键 | |
| C. | 含有金属元素的离子一定是阳离子 | |
| D. | 非金属元素的化合物一定不含有离子键 |