题目内容
18.将饱和三氯化铁溶液滴入沸水中时,液体变为红褐色,得到的是Fe(OH)3胶体,由此分散系进行试验:(1)将其装入U型管内,用石墨做电极,接通直流电源,通电一段时间后;发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带正电荷,这种现象称为电泳
(2)若其中逐滴加入过量稀硫酸,现象是先出现红褐色沉淀,后沉淀溶解,得棕黄色溶液,原因是电解质使Fe(OH)3胶体聚沉,随着稀硫酸的加入,H+与Fe(OH)3发生反应,Fe(OH)3+3H+═Fe3++3H2O,使沉淀溶解
(3)若胶体中含有杂质FeCl3,则鉴别含有FeCl3的方法是加硫氰化钾溶液,若变红色,说明含有FeCl3,用渗析方法额可以提纯此分散系.
分析 实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液;
(1)Fe(OH)3胶粒带正电荷;
(2)胶体遇电解质发生聚沉;
(3)根据胶体能够发生聚沉以及酸能和Fe(OH)3 胶体反应;
(4)检验三价铁了用硫氰化钾溶液;胶粒不能透过半透膜,离子可以透过半透膜,可用渗析的方法分离.
解答 解:实验室制备Fe(OH)3胶体的操作要点:蒸馏水先煮沸;再加入饱和的FeCl3溶液;继续煮沸至红褐色,停止加热,
故答案为:红褐;Fe(OH)3胶体;
(1)Fe(OH)3胶体粒子带正电荷,在电场作用下发生电泳现象.带正电荷的胶粒向阴极移动,故阴极附近颜色逐渐加深,
故答案为:逐渐变深;Fe(OH)3胶粒带正电荷;电泳;
(2)硫酸铵溶液中存在阴、阳离子,带有正、负电荷,Fe(OH)3胶粒带有正电荷,被负电荷中和,Fe(OH)3胶体发生聚沉现象,形成Fe(OH)3沉淀,
故答案为:形成红褐色沉淀;电解质电离出的离子中和了胶体粒子所带电荷,使Fe(OH)3胶体聚沉;
(3)硫酸中存在H+和硫酸根离子,一方面硫酸根离子带的负电荷中和Fe(OH)3胶粒所带的正电荷,胶体聚沉,另一方面Fe(OH)3是一种碱,可与H+反应,故沉淀溶解:Fe(OH)3+3H+═Fe3++3H2O,
故答案为:先出现红褐色沉淀,后沉淀溶解,得棕黄色溶液;电解质使Fe(OH)3胶体聚沉,随着稀硫酸的加入,H+与Fe(OH)3发生反应,Fe(OH)3+3H+═Fe3++3H2O,使沉淀溶解;
(4)检验三价铁了用硫氰化钾溶液,加硫氰化钾溶液,若变红色,说明含有FeCl3;胶粒不能透过半透膜,离子可以透过半透膜,可用渗析的方法分离;
故答案为:加硫氰化钾溶液,若变红色,说明含有FeCl3;渗析.
点评 本题考查胶体的制备、性质、离子检验等,题目难度不大,易错点为胶体的制备,本题重点把握胶体的制备方法.

| A. | C2H4 | B. | C2H2 | C. | C6H6 | D. | C3H8 |
 常温下,向20mL 0.1mol•L-1 CH3COOH溶液中加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下,向20mL 0.1mol•L-1 CH3COOH溶液中加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a和b之间的溶液中只存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | b与c之间的溶液中不存在:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| C. | c点时,V(NaOH溶液)<20mL,且c(CH3COO-)=c(Na+) | |
| D. | a、b、c点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$均相等 |
| A. | 在酸性重铬酸钾溶液中加入少量乙醇:3COH3CH2OH+2Cr2O72-+13H+→4Cr3++3CH3COO-+11H2O | |
| B. | AlCl3•6H2O与SOCl2混合并加热:AlCl3•6H2O+3SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3SO2↑+9HCl | |
| C. | SbCl3水解:SbCl3+H2O?SbOCl+2HCl | |
| D. | 在碘的四氯化碳溶液中加浓的KI溶液:I2+3I-?I3- |
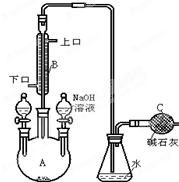 制备一溴异丙苯的实验装置如图所示,下列操作正确的是( )
制备一溴异丙苯的实验装置如图所示,下列操作正确的是( )| A. | 装在左侧分液漏斗中的药品是苯和液溴 | |
| B. | 右侧分液漏斗中的物质的作用是催化剂 | |
| C. | 可向锥形瓶中加入硝酸酸化的AgNO3溶液,有淡黄色沉淀产生,说明此反应为取代反应 | |
| D. | 可在B与锥形瓶之间连接一个 装置并加入CCl4液体来除去HBr中溴蒸气 装置并加入CCl4液体来除去HBr中溴蒸气 |
| A. | 1-甲基丙烷 | B. | 2-乙基丁烷 | C. | 3,3-二甲基丁烷 | D. | 2-甲基丁烷 |
| A. | SO2和SiO2 | B. | CO2 和NaCl | C. | NH4Cl 和HCl | D. | H2O2和C3H6 |
| A. | 含有NA个氮原子的氮气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的原子数小于3NA | |
| C. | 在常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| D. | 1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子 |