题目内容
11.Na、Mg、Al三种元素单质的还原性由强到弱的顺序是Na>Mg>Al;其最高价氧化物的化学式分别为Na2O、MgO、Al2O3,其中属于两性氧化物的是Al(OH)3.分析 元素的金属性越强,其单质的还原性越强;主族元素最高正价与去族序数相等,但O、F元素除外,根据化合物中化合价的代数和为0书写其最高价氧化物的化学式;氢氧化铝既能与强酸反应又能与强碱反应,属于两性氢氧化物.
解答 解:元素的金属性越强,其单质的还原性越强,金属性Na>Mg>Al,所以单质的还原性Na>Mg>Al;主族元素最高正价与去族序数相等,但O、F元素除外,所以Na、Mg、Al的最高化合价为+1、+2、+3价,根据化合物中化合价的代数和为0知,其最高价氧化物分别是Na2O、MgO、Al2O3;Al(OH)3既能与强酸反应又能与强碱反应,属于两性氢氧化物,故答案为:Na>Mg>Al;Na2O、MgO、Al2O3;Al(OH)3.
点评 本题考查金属性强弱判断、化学式的书写、两性氢氧化物等知识点,明确金属性强弱判断方法、化学式书写方法等即可解答,注意氢氧化铝的两性,为常考查点.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
1.下列有关铝土矿中提炼铝的说法不正确的是( )
| A. | 铝土矿中的铝元素是以化合态存在的,需用化学方法把铝元素变成游离态 | |
| B. | 提炼过程中,先将铝土矿净化提取氧化铝,再进行冶炼 | |
| C. | 可用常见的还原剂把氧化铝中的铝还原出来 | |
| D. | 冶炼铝的方法与工业冶炼钠、镁相似,可用电解法 |
19.下列有关说法不正确的是( )
| A. | m g由乙烯和丙烯组成的混合物完全燃烧消耗氧气为$\frac{24m}{7}$g | |
| B. | 14g乙烯和丙烯混合物含有3NA个原子 | |
| C. | 从乙烯与溴发生加成反应生成1,2一二溴乙烷可知乙烯分子的碳碳双键中有一个键不稳定,易发生断裂 | |
| D. | 甲烷中含乙烯杂质可以用酸性KMnO4溶液除去 |
6. 常温下,向20mL 0.1mol•L-1 CH3COOH溶液中加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下,向20mL 0.1mol•L-1 CH3COOH溶液中加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
 常温下,向20mL 0.1mol•L-1 CH3COOH溶液中加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下,向20mL 0.1mol•L-1 CH3COOH溶液中加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a和b之间的溶液中只存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | b与c之间的溶液中不存在:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| C. | c点时,V(NaOH溶液)<20mL,且c(CH3COO-)=c(Na+) | |
| D. | a、b、c点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$均相等 |
16.某链烃0.2mol完全燃烧生成的CO2恰好可被2L 1mol/L NaOH溶液吸收生成正盐,则该烃可能是( )
| A. | 乙烷 | B. | 丙烷 | C. | 正丁烷 | D. | 异戊烷 |
3.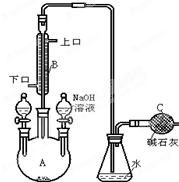 制备一溴异丙苯的实验装置如图所示,下列操作正确的是( )
制备一溴异丙苯的实验装置如图所示,下列操作正确的是( )
 制备一溴异丙苯的实验装置如图所示,下列操作正确的是( )
制备一溴异丙苯的实验装置如图所示,下列操作正确的是( )| A. | 装在左侧分液漏斗中的药品是苯和液溴 | |
| B. | 右侧分液漏斗中的物质的作用是催化剂 | |
| C. | 可向锥形瓶中加入硝酸酸化的AgNO3溶液,有淡黄色沉淀产生,说明此反应为取代反应 | |
| D. | 可在B与锥形瓶之间连接一个 装置并加入CCl4液体来除去HBr中溴蒸气 装置并加入CCl4液体来除去HBr中溴蒸气 |
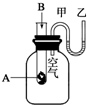 为了研究化学反应A+B=C+D的能量变化,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:
为了研究化学反应A+B=C+D的能量变化,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题: .
.