题目内容
【题目】环戊烯(![]() ,
,![]() )是一种重要的有机化工原料,可用环成二烯(
)是一种重要的有机化工原料,可用环成二烯(![]() ,
,![]() )制备。已知:
)制备。已知:
反应Ⅰ ![]()
![]()
反应Ⅱ ![]() (环戊烷)
(环戊烷) ![]()
反应Ⅲ ![]()
![]()
![]()
(1)某温度下,将环戊二烯和HI按物质的量之比1∶2(总物质的量为amol)充入容积为2L的恒容密闭容器中,发生反应:![]() 。
。
①该反应自发进行的条件是__________。
②下列有关该反应的叙述,不正确的是__________。
A.气体压强不变,说明反应达到平衡状态
B.升高温度,有利于提高环戊烯的产率
C.反应达到平衡时,C5H6和HI的转化率相等
D.通入惰性气体,有利于提高环戊二烯的平衡转化率
(2)以![]() 为催化剂,如图1为25℃时环戊二烯氢化过程,环戊烯与环戊烷的各组分含量(物质的量含量)随时间(t)的变化。为研究不同温度下催化剂活性,测得不同温度下反应4h时的转化率和选择性数据如图2(其它条件相同)。
为催化剂,如图1为25℃时环戊二烯氢化过程,环戊烯与环戊烷的各组分含量(物质的量含量)随时间(t)的变化。为研究不同温度下催化剂活性,测得不同温度下反应4h时的转化率和选择性数据如图2(其它条件相同)。
①环成二烯氢化制环成烯的最佳反应温度为__________,选择该温度的原因是__________。
②升高温度,环戊二烯转化率提高而环戊烯选择性降低,其原因是__________。
③在图1中画出40℃时环戊烯含量随t变化趋势的曲线。__________
(3)实际生产中,常由双环戊二烯通入水蒸气解聚成环戊二烯:

某温度,加入总压为70kPa的双环成二烯和水蒸气,达到平衡后总压为110kPa,双环戊二烯的转化率为80%,则该反应的平衡常数![]() __________(对于气相反应,用某组分B的平衡压强
__________(对于气相反应,用某组分B的平衡压强![]() 代替物质的量浓度
代替物质的量浓度![]() 也可表示平衡常数,记作
也可表示平衡常数,记作![]() )。
)。
【答案】低温 BD 30℃ 该温度下,催化剂的活性好且选择性好 温度升高,反应Ⅰ和反应Ⅱ的反应速率都加快,但对反应Ⅱ速率的影响大于反应Ⅰ 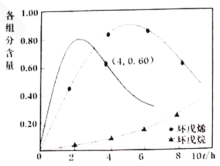 640
640
【解析】
(1)反应Ⅰ:![]()
![]()
反应Ⅲ:![]()
![]()
反应Ⅰ-反应Ⅲ得:![]() ,其
,其![]()
![]() =
=![]() 。
。
①该反应的![]()
![]() <0,
<0,![]() <0,当
<0,当![]() -T·
-T·![]() <0时,反应自发进行,即T很小(低温)时,该反应自发进行,故答案为:低温;
<0时,反应自发进行,即T很小(低温)时,该反应自发进行,故答案为:低温;
②A.恒容时,正反应是气体压强减小的反应,当气体压强不变,说明反应达到平衡状态,A正确;
B.正反应是放热反应,升高温度,平衡逆向移动,环戊烯的产率下降,B错误;
C.起始时,环戊二烯和HI按物质的量之比1∶2,则二者转化率之比=![]() =1:1,即反应达到平衡时,C5H6和HI的转化率相等,C正确;
=1:1,即反应达到平衡时,C5H6和HI的转化率相等,C正确;
D.恒容,通入惰性气体,平衡不发生移动,环戊二烯的平衡转化率不变,D错误;
故答案为:BD;
(2)①由图2可知,30℃时,环戊烯的选择性最大且环戊二烯的转化率较高(催化剂活性好),所以,30℃是环戊二烯氢化制环戊烯的最佳反应温度,故答案为:30℃;该温度下,催化剂的活性好且选择性好;
②温度升高,反应Ⅰ和反应Ⅱ的反应速率都加快,但对反应Ⅱ速率的影响大于反应Ⅰ,所以出现升高温度,环戊二烯转化率提高而环戊烯选择性降低,故答案为:温度升高,反应Ⅰ和反应Ⅱ的反应速率都加快,但对反应Ⅱ速率的影响大于反应Ⅰ;
③40℃时,反应速率加快,环戊烯含量达到较高值的时间缩短,且因环戊烯的选择性降低导致环戊烯含量最大值减小,结合选择性公式可知,40℃,4h时,环戊烯和环戊烷的含量比应为0.6:0.4,所以,40℃时环戊烯含量随t变化趋势的曲线如图所示: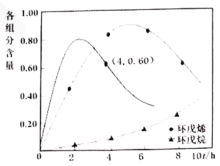 ,故答案为:
,故答案为: ;
;
(3)设双环戊二烯的起始分压为p,水蒸气分压为p0,则到达平衡后双环戊二烯分压减小了0.8p,双环戊二烯的分子式为:C10H12,故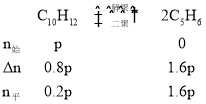 ,p+p0=70kPa,0.2p+1.6p+p0=1.8p+p0=110kPa,解得:p=50kPa,所以:
,p+p0=70kPa,0.2p+1.6p+p0=1.8p+p0=110kPa,解得:p=50kPa,所以:![]() =640/span>,故答案为:640。
=640/span>,故答案为:640。