题目内容
7.某甲醇(CH3OH)燃料电池原理如图1所示.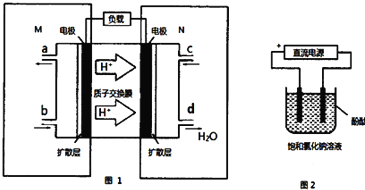
①M区发生反应的电极反应式为CH3OH-6e-+H2O═CO2↑+6H+.
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解池的总反应离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$ H2↑+Cl2↑+2OH-.假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为0.16g(忽略溶液体积变化).
分析 ①首先根据氢离子的移动方向来确定正负极,然后根据原电池原理,最后书写电极反应式;
②整个电路中转移电子的数目相等,可以根据电子转移的数目相同来列出已知物质和未知物质之间关系式,然后通过关系来求解.
解答 解:①M区是质子流出的一极,应是原电池的负极,发生氧化反应,电极反应式为:CH3OH-6e-+H2O=CO2+6H+,故答案为:CH3OH-6e-+H2O=CO2+6H+;
②用惰性电极,电解饱和食盐水总的电极反应式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2 OH-,pH值变为13时,pOH=1,C(OH-)=10-1mol/L,n(OH-)=10-1mol/L×300mL×10-3L/mL=0.03mol,由方程式CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-
可知 CH3OH~6e-~6OH-
32g 6mol
m(CH3OH) 0.03mol
则m(CH3OH)=$\frac{32g×0.03mol}{6}$=0.16g,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;0.16g.
点评 本题考查学生原电池、电解池的工作原理以及应用知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.将a mol/L Al2(SO4)3和钾离子浓度为2b mol/L的 K2SO4混合溶液500mL加水稀释到2L,则稀释后的溶液中SO42-的浓度为( )mol/L.
| A. | $\frac{a+b}{4}$ | B. | $\frac{3a+2b}{4}$ | C. | 4(a+b) | D. | 4(3a+b) |
15.关于胶体和溶液的区别,下列叙述中正确的是( )
| A. | 胶体通直流电胶粒向两极移动,非电解质溶液通直流电溶质不移动 | |
| B. | 溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸 | |
| C. | 溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明显光带 | |
| D. | 溶液稳定,放置后不会生成沉淀;胶体不稳定,放置会生成沉淀 |
2.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等.下列反应与Br2+SO2+2H2O=H2SO2+2HBr相比较,水的作用相同的是( )
| A. | 电解水:2H20═2H2↑+O2↑ | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2F2+H2O═4HF+O2 | D. | 3NO2+H2O═2HNO3+NO |
12.下列说法正确的是( )
| A. | 在测定溶液的pH时,先用蒸馏水湿润,后用玻璃棒醮取溶液点在试纸中部,再与标准比色卡比较 | |
| B. | 某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42- | |
| C. | 提纯含有少量Ba(NO3)2杂质的KNO3溶液,可以使用的方法为加入过量的K2CO3溶液,过滤除去沉淀,所得溶液中补加适量HNO3 | |
| D. | 实验过程中用不完的钠和白磷应直接扔到废液缸中 |
19.恒温恒压的密闭容器中发生反应A(g)+2B(g)?3C(g),能说明反应达到平衡状态的是( )
| A. | 容器内的压强不再变化 | |
| B. | 混合气体的密度不再变化 | |
| C. | 单位时间消耗2molA,同时消耗6molC | |
| D. | 混合气体的平均相对分子质量不再变化 |
17.下列有关离子检验的操作和实验结论都正确的是
( )
| 选项 | 实验操作现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶液 | 该溶液中一定含有SO${\;}_{4}^{2-}$ |
| B | 向某溶液中滴入硝酸酸化硝酸银溶液产生白色沉淀 | 该溶液中一定含有Cl- |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的五色气体 | 该溶液中一定含有CO${\;}_{3}^{2-}$ |
| D | 向某溶液中加入氯化钡溶液,产生白色沉淀,生成白色沉淀,将沉淀过滤后,在沉淀中加入稀盐酸,沉淀部分溶解,并产生无色无味能使澄清石灰水变浑浊的气体 | 该溶液中既有CO${\;}_{3}^{2-}$又有SO${\;}_{4}^{2-}$ |
| A. | A | B. | B | C. | C | D. | D |
 用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: