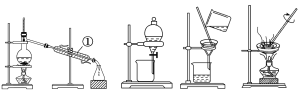
��Ŀ����
����Ŀ���������������У�����һ�����ʵ�������������ֲ�ͬ��
��MgO��Na2O��CO2��CuO
��HCl��H2O��H2SO4��HNO3
��NaOH��Na2CO3��KOH��Cu(OH)2
��1����������������(�ѧʽ)��
A________��B________��C _________
��2����������������ÿ�����һ��������NaHCO3���÷�Ӧ________(������������������)������ԭ��Ӧ��
��3��д������C������ϡ���ᷴӦ�����ӷ���ʽ��_____________________________
��4��HCO![]() ��H����OH������Һ�ж����ܴ������棬�������ӷ���ʽ˵��______________________
��H����OH������Һ�ж����ܴ������棬�������ӷ���ʽ˵��______________________
���𰸡�CO2H2ONa2CO3����CO![]() ��2H��===H2O��CO2��HCO
��2H��===H2O��CO2��HCO![]() ��H��===CO2����H2O��HCO
��H��===CO2����H2O��HCO![]() ��OH��===CO
��OH��===CO![]() ��H2O
��H2O
��������
������Ҫ�������ӷ���ʽ����д��
��1����������������(�ѧʽ)��
A CO2������������������������ڼ����������ѡCO2��B H2O�����������ʣ��������������ᣬ��ѡH2O��C Na2CO3�����Σ������������ڼ��ѡNa2CO3��
��2����������������ÿ�����һ��������NaHCO3��������û��Ԫ�ػ��ϼ۵ı仯�����Ը÷�Ӧ����������ԭ��Ӧ��
��3������C������ϡ���ᷴӦ�����ӷ���ʽ��![]() ��2H+
��2H+![]() CO2����H2O��
CO2����H2O��
��4��HCO![]() ��H����OH������Һ�ж����ܴ������棬�������ӷ���ʽ˵����HCO
��H����OH������Һ�ж����ܴ������棬�������ӷ���ʽ˵����HCO![]() ��H��===CO2����H2O��HCO
��H��===CO2����H2O��HCO![]() ��OH��===CO
��OH��===CO![]() ��H2O��
��H2O��

����Ŀ��ʵ����
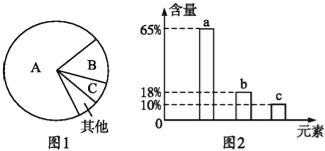
��һ��ʵ��������һƿ����һ�������ʵ��ռ���Ʒ��ijѧ�����к͵ζ����ⶨ�ռ�Ĵ��ȣ����ռ����������������Ӧ�������ʵ��ش�
��1����ȷ��ȡ��5g�ռ���Ʒ���100 mL����Һ����Ҫ����Ҫ��������Ͳ���ձ�����������������ƽ�⣬�������õ��IJ��������У�____________��_____________��
��2��ȡ10.00 mL����Һ��ѡ����ͼ��_________����A��B������ȡ��

��3����0.5000mol/L������ζ������ռ���Һ���Է�̪Ϊָʾ�����ζ�ʱ������ת�ζ��ܲ������������ֲ�ͣ��ҡ����ƿ������ע��___________��ֱ���ζ��յ㡣�ζ��ﵽ�յ�ı�־�ǣ�_________��
��4�������������ݣ��ռ�Ĵ���Ϊ��_______________________������=�����ʵ�����/��Ʒ��������100����
�ζ����� | ����Һ�����mL�� | �����������mL�� | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 10.00 | 0.50 | 20.40 |
�ڶ��� | 10.00 | 4.00 | 24.10 |
������������ԭ�ζ�ʵ��������к͵ζ����ƣ�����֪Ũ�ȵ���������Һ�ζ�δ֪Ũ�ȵĻ�ԭ����Һ��֮������Ѫ�Ƶĺ���ʱ����������ʵ�飺
�ٿɽ�2mLѪҺ������ˮϡ�ͺ������м�����������泥�NH4��2C2O4���壬��Ӧ���� CaC2O4��������������ϡ���ᴦ����H2C2O4��Һ��
�ڽ��ٵõ���H2C2O4��Һ����������KMnO4��Һ�ζ�����������ΪCO2����ԭ����ΪMn2+��
���յ�ʱ��ȥ20mL l.0��l0��4 mol/L��KMnO4��Һ��
��1��д����KMnO4�ζ�H2C2O4�����ӷ���ʽ_____________________��
��2���ζ�ʱ����KMnO4��Һװ��________��������ʽ��������ʽ�����ζ����С�
��3�����㣺ѪҺ�к������ӵ�Ũ��Ϊ_____mol��L-1��
���𰸡� ��ͷ�ι� 100mL����ƿ A ��ƿ����ɫ�ı仯 ���һ������ν���ƿ�ں�ɫ��ȥ��30s����ԭ 80% 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2��+8H2O ��ʽ 2.5��10-3
����������һ����1������һ��Ũ�ȵ���Һ����Ҫ�õ�100mL������ƿ������Ҫ��ͷ�ιܶ��ݡ�
��2�����������������ҺӦ��ʹ�ü�ʽ�ζ��ܣ�ѡ��A��
��3���ζ�ʱ�۾�Ӧ��ע����ƿ��Һ����ɫ�ı仯���ﵽ�յ�ʱҪ��ʱֹͣ�ζ����ζ��յ������Ϊ����Һ��ɫ��ȥ��30s����ԭ�����Դ�Ϊ�����һ������ν���ƿ�ں�ɫ��ȥ��30s����ԭ��
��4�����εζ���������������ֱ�Ϊ19.90mL��20.10mL������ƽ��Ϊ20.00mL������HCl�����ʵ���Ϊ20��0.5��1000=0.01mol��������������Ϊ0.01mol����Ϊ����100mL��Һȡ��10mL���еĵζ�������ԭ������������Ϊ0.1mol������Ϊ4g����������Ϊ4��5=80%��
��������1��KMnO4�ζ�H2C2O4�ķ���ʽΪ��2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2�� + 8H2O����Ӧ�����ӷ���ʽΪ��2MnO4-+ 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2
��2��������ؾ���ǿ�����ԣ���������ʽ�ζ����¶˵��ܣ�����ֻ������ʽ�ζ���ʢ�š�
��3�����ݷ�Ӧ���������̣��õ����µĹ�ϵʽCa2+��CaC2O4��H2C2O4��2/5 KMnO4������Ca2+��KMnO4��5/2�����������Ϊ20��1��10-4��1000=2��10-6mol������Ca2+Ϊ5��10-6mol������Ũ��Ϊ5��10-6��0.002��2.5��10-3mol/L��
�����͡�ʵ����
��������
20
����Ŀ�����ᡢ�����̼���ǻ�ѧʵ����о��г��õļ����ᡣ
��֪�����£�Ka��CH3COOH����1.7��10��5 mol�� L��1��
H2CO3�ĵ��볣��Ka1��4.2��10��7mol��L��1��Ka2��5.6��10��11mol��L��1��
��1�����������ӷ���ʽ����̼������ˮ��Һ�Լ��Ե�ԭ��________________��
�ڳ����£����ʵ���Ũ����ͬ������������Һ��a��̼������Һ b����������Һ c������������Һ d��̼��������Һ����pH�ɴ�С��˳���ǣ�___________������ţ���
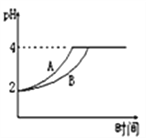
��2�������£�ȡ pH=2������ʹ�����Һ��100mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯����ͼ��ʾ�����ʾ������ҺpH�仯��������___ ������A������B�������������м����Zn����Ϊm1��������Һ�м����Zn����Ϊ m2���� m1 ___ m2 �� ѡ����<������=������>������
��3��ij�¶��£�pH��Ϊ4������ʹ�����Һ�ֱ��ˮϡ�ͣ���pH����Һ����仯������ͼ���£�����a��b��c�����Ӧ����Һ��ˮ�ĵ���̶��ɴ�С��˳����_______���ô�����Һϡ�����У����и���һ����С����______________��
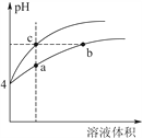
a��c(H��) b��c(OH��)
c�� ![]() d��
d�� 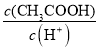
��4����Cr2O72-�ķ�ˮ���Խϴ�ij������ˮ�к�5.0��10-3mol/L��Cr2O72-��Ϊ��ʹ��ˮ���ŷŴ�꣬�������´�����
![]()
��������������ķ�ˮ��c(Cr3+)=6.0��10-7mol/L��������ķ�ˮ�� pH=___________��{Ksp[Cr(OH)3]=6.0��10-31}