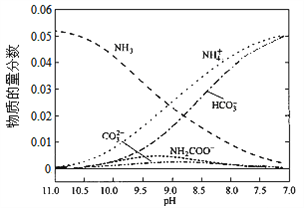
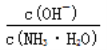题目内容
【题目】实验题
(一)实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中所含杂质与酸不反应,请根据实验回答:
(1)将准确称取的5g烧碱样品配成100 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的玻璃仪器有:____________、_____________。
(2)取10.00 mL待测液,选择右图中_________(填A或B)来移取。

(3)用0.5000mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂。滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________,直到滴定终点。滴定达到终点的标志是:_________。
(4)根据下列数据,烧碱的纯度为:_______________________(纯度=纯物质的质量/样品的质量×100%)
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(二)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式_____________________。
(2)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(3)计算:血液中含钙离子的浓度为_____mol·L-1。
【答案】 胶头滴管 100mL容量瓶 A 锥形瓶内颜色的变化 最后一滴盐酸滴进锥形瓶内红色褪去且30s不复原 80% 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 酸式 2.5×10-3
【解析】(一)(1)配制一定浓度的溶液,需要用到100mL的容量瓶,还需要胶头滴管定容。
(2)待测的氢氧化钠溶液应该使用碱式滴定管,选择A。
(3)滴定时眼睛应该注意锥形瓶内液体颜色的变化,达到终点时要及时停止滴定。滴定终点的现象为:溶液红色褪去且30s不复原,所以答案为:最后一滴盐酸滴进锥形瓶内红色褪去且30s不复原。
(4)两次滴定加入的盐酸的体积分别为19.90mL和20.10mL,所以平均为20.00mL,所以HCl的物质的量为20×0.5÷1000=0.01mol,所以氢氧化钠为0.01mol,因为配了100mL溶液取出10mL进行的滴定,所以原来的氢氧化钠为0.1mol,质量为4g,质量分数为4÷5=80%。
(二)(1)KMnO4滴定H2C2O4的方程式为:2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑ + 8H2O,对应的离子方程式为:2MnO4-+ 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2
(2)高锰酸钾具有强氧化性,会氧化碱式滴定管下端的橡胶管,所以只能用酸式滴定管盛放。
(3)根据反应的整个过程,得到如下的关系式Ca2+~CaC2O4~H2C2O4~2/5 KMnO4,所以Ca2+是KMnO4的5/2倍。高锰酸钾为20×1×10-4÷1000=2×10-6mol,所以Ca2+为5×10-6mol,所以浓度为5×10-6÷0.002=2.5×10-3mol/L。
【题型】实验题
【结束】
20
【题目】盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5 mol· L-1;
H2CO3的电离常数Ka1=4.2×10-7mol·L-1、Ka2=5.6×10-11mol·L-1。
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因________________。
②常温下,物质的量浓度相同的下列四种溶液:a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、碳酸氢钠溶液。其pH由大到小的顺序是:___________(填序号)。
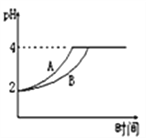
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示。则表示醋酸溶液pH变化的曲线是___ (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。则 m1 ___ m2 ( 选填“<”、“=”、“>”)。
(3)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图如下,其中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是_______;该醋酸溶液稀释过程中,下列各量一定变小的是______________。
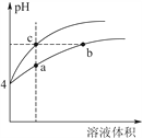
a.c(H+) b.c(OH-)
c. ![]() d.
d. 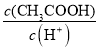
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=___________。{Ksp[Cr(OH)3]=6.0×10-31}
【答案】 HCO3— + H2O![]() H2CO3 + OH— cadb B < b=c>a ad pH=6
H2CO3 + OH— cadb B < b=c>a ad pH=6
【解析】(1)①碳酸氢钠溶液显碱性的原因是,碳酸氢根的水解大于电离,所以离子方程式为:HCO3— + H2O![]() H2CO3 + OH—。
H2CO3 + OH—。
②根据题目给出的电离平衡常数,得到电离出氢离子的能力为:CH3COOH>H2CO3>HCO3-,所以得到水解能力为CH3COO-<HCO3-<CO32-。明显氢氧化钠的碱性最强,其他物质的碱性顺序由上可得,所以碱性为NaOH>Na2CO3>NaHCO3>CH3COONa。物质的量浓度相同时,其pH由大到小的顺序是:NaOH>Na2CO3>NaHCO3>CH3COONa。即cadb。
(2)醋酸存在电离平衡,Zn和氢离子反应使氢离子浓度减小,电离平衡向正反应方向移动,电离出一定量的氢离子减缓了氢离子浓度的下降,所以醋酸的pH上升的比较慢,代表醋酸的是曲线B(盐酸没有电离平衡,所以氢离子的减小比较快)。如果两个溶液中反应的锌一样多,则应该反应相同的氢离子,盐酸就会减少对应的氢离子浓度,而醋酸因为存在电离平衡,减少的氢离子浓度会比盐酸少(此时电离平衡向正反应方向移动),所以醋酸的氢离子浓度会大于盐酸的氢离子浓度,即醋酸的pH小于盐酸。题目图像中最后两者的pH相等,所以醋酸中应该多加一些Zn,继续反应氢离子,使pH上升,才可能使两个溶液pH相等,即醋酸中应该多加Zn,所以m1 < m2。
(3)理论上醋酸和盐酸都不影响水的电离,应该是酸电离出来的氢离子在抑制水的电离,所以氢离子浓度越大(pH越小),对于水的电离的抑制越强,水电离的越少。因为pH的关系是b=c>a,所以水的电离程度为:b=c>a。醋酸加水稀释,溶液中的氢离子浓度一定减小,选项a正确。氢离子浓度减小则氢氧根浓度一定增大(乘积等于水的离子积常数),选项b错误。选项c可以进行如下计算:
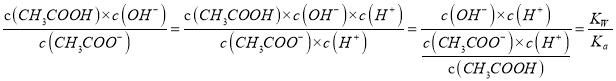
所以![]() 等同于两个常数的比值,只与温度有关,选项c错误。
等同于两个常数的比值,只与温度有关,选项c错误。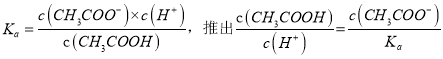 ,随着加水稀释,醋酸根的浓度逐渐减小,所以
,随着加水稀释,醋酸根的浓度逐渐减小,所以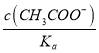 减小(Ka不变),即
减小(Ka不变),即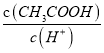 减小,选项d正确。
减小,选项d正确。
(4)流程最后将Cr3+转化为Cr(OH)3的沉淀除去,所以溶液对于Cr(OH)3为饱和溶液。因为c(Cr3+)=6.0×10-7mol/L,则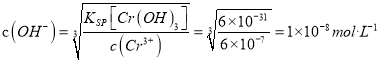 ,所以c(H+)=1×10-6mol/L,即pH=6。
,所以c(H+)=1×10-6mol/L,即pH=6。

【题目】根据所给的信息和标志,判断下列说法正确的是
A | B | C | D |
《本草纲目拾遗》中述“铁线粉”:“粤中洋行有舶上铁丝,……日久起销,用刀刮其销,.....,所刮下之销末,名铁线粉” | 《本草纲目》:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者” | 可燃冰 |
|
“铁线粉”是Fe3O4 | 利用KNO3的氧化性 | “可燃冰”是可以燃烧的水 | “绿色食品”是指绿色的食品 |
A. A B. B C. C D. D