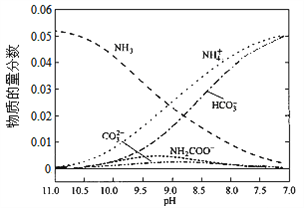
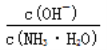题目内容
【题目】分析下列氧化还原反应:
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。
(1)该反应的还原剂是________,还原产物是________。
(2)该反应中氧化剂与氧化产物的物质的量之比是________。
(3)当有2 mol HNO3参加反应时,被氧化的物质是________ g。
【答案】CuNO22∶132
【解析】
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O中,N元素的化合价降低,由反应可知,1molCu反应生成2molNO2,以此来解答。
双线桥法分析如下:

(1)该反应的还原剂是Cu,氧化剂是HNO3,还原产物为NO2,氧化产物为Cu(NO3)2;
(2)当有4 mol HNO3参加反应时,作氧化剂的HNO3只有2 mol,对应的氧化产物Cu(NO3)2为1 mol,则氧化剂与氧化产物的物质的量之比为2∶1;
(3)有2 mol HNO3参加反应时,被氧化的Cu为0.5 mol,即32 g。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
【题目】根据所给的信息和标志,判断下列说法正确的是
A | B | C | D |
《本草纲目拾遗》中述“铁线粉”:“粤中洋行有舶上铁丝,……日久起销,用刀刮其销,.....,所刮下之销末,名铁线粉” | 《本草纲目》:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者” | 可燃冰 |
|
“铁线粉”是Fe3O4 | 利用KNO3的氧化性 | “可燃冰”是可以燃烧的水 | “绿色食品”是指绿色的食品 |
A. A B. B C. C D. D