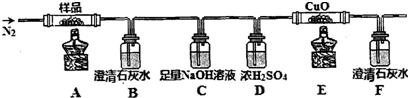
题目内容
3.当a g NaHCO3和Na2CO3的混合物加热至质量不在减少时,变成b g,则原混合物中NaHCO3和Na2CO3的质量比应是( )| A. | $\frac{a-b}{b}$ | B. | $\frac{b}{a-b}$ | C. | $\frac{b-0.63a}{a-b}$ | D. | $\frac{a-b}{b-0.63a}$ |
分析 加热碳酸钠和碳酸氢钠的混合物,碳酸氢钠完全分解,根据反应的方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑,利用差量法计算.
解答 解:碳酸钠较稳定,加热不分解,只有碳酸氢钠分解,
设混合物中含有xgNaHCO3,则
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑△m
2×84 62
xg (a-b)g
x=$\frac{2×84×(a-b)}{62}$g,
则NaHCO3和Na2CO3的混合物中Na2CO3的质量为(a-$\frac{2×84×(a-b)}{62}$)g=$\frac{168b-106a}{62}$g.
二者的质量之比为$\frac{2×84×(a-b)}{62}$:$\frac{168b-106a}{62}$=(a-b):(b-0.63a),
故选D.
点评 本题考查混合物的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度不大,注意碳酸氢钠的性质,利用差量法结合化学方程式计算.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
11.在标准状况下750mL含O3的氧气,其中若O3完全分解,其体积为780mL.如果将此含有的O3的氧气1L,通入适量的KI溶液中,发生如下反应,2KI+O3+H2O=2KOH+I2+O2,则析出I2的质量为( )
| A. | 0.68g | B. | 0.81g | C. | 0.91g | D. | 1.21g |
4.下列物品或设备:
①水泥路桥 ②门窗玻璃 ③水晶项链 ④石英钟表 ⑤玛瑙手镯 ⑥硅太阳能电池 ⑦光导纤维 ⑧计算机芯片.
所用材料为SiO2或要用到SiO2的是( )
①水泥路桥 ②门窗玻璃 ③水晶项链 ④石英钟表 ⑤玛瑙手镯 ⑥硅太阳能电池 ⑦光导纤维 ⑧计算机芯片.
所用材料为SiO2或要用到SiO2的是( )
| A. | ①②③④⑤⑦ | B. | 全部 | C. | ③④⑤⑦⑧ | D. | ①②⑦⑧ |

 ,H2O2的结构式为H-O-O-H,N-H键的键能为a kJ•mol-1,N-N键的键能为b kJ•mol-1,H-O键的键能为c kJ•mol-1,O-O键的键能为d kJ•mol-1,
,H2O2的结构式为H-O-O-H,N-H键的键能为a kJ•mol-1,N-N键的键能为b kJ•mol-1,H-O键的键能为c kJ•mol-1,O-O键的键能为d kJ•mol-1, 键的键能为e kJ•mol-1,则1mol N2H4与足量H2O2反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=(4a+b-4c+d-e)kJ•mol-1.
键的键能为e kJ•mol-1,则1mol N2H4与足量H2O2反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=(4a+b-4c+d-e)kJ•mol-1. :3,3,5-三甲基庚烷;
:3,3,5-三甲基庚烷;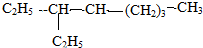 :3-乙基辛烷;
:3-乙基辛烷;