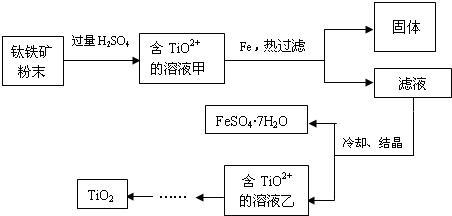
题目内容
14.H2SO4的摩尔质量为98g/mol,0.1molH2SO4的质量为9.8g,其中含有0.4mol氧原子,可完全电离出0.2mol氢离子,0.1mol硫酸根离子.分析 摩尔质量以g/mol为单位,数值上等于其相对分子质量,根据m=nM计算硫酸的质量,氧原子物质的量为硫酸的4倍,电离方程式为:H2SO4=2H++SO42-,氢离子物质的量为硫酸的2倍,硫酸根物质的量等于硫酸的物质的量.
解答 解:H2SO4的摩尔质量为98g/mol,0.1molH2SO4的质量为 0.1mol×98g/mol=9.8g,其中含有氧原子为0.1mol×4=0.4mol,电离方程式为:H2SO4=2H++SO42-,电离得到氢离子为0.1mol×2=0.2mol,电离得到硫酸根为0.1mol,
故答案为:98g/mol;9.8g;0.4;0.2;0.1.
点评 本题考查物质的量有关计算,比较基础,旨在考查学生对基础知识的巩固.

练习册系列答案
相关题目
19.设NA表示阿伏伽罗常数,下列说法正确的是( )
| A. | 1mol氦气中有2NA个氦原子 | B. | 7g氮气中含有NA个氮原子 | ||
| C. | 0.3 mol Na2SO4中含有0.6NA个Na+ | D. | 18g水中所含的电子数为8NA |
3.当a g NaHCO3和Na2CO3的混合物加热至质量不在减少时,变成b g,则原混合物中NaHCO3和Na2CO3的质量比应是( )
| A. | $\frac{a-b}{b}$ | B. | $\frac{b}{a-b}$ | C. | $\frac{b-0.63a}{a-b}$ | D. | $\frac{a-b}{b-0.63a}$ |
 ; ③CH3CH2-CH2-CH2OH;④CH3-C≡C-CH3;
; ③CH3CH2-CH2-CH2OH;④CH3-C≡C-CH3;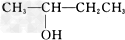 ;⑦CH3CH2CH2OCH3;⑧
;⑦CH3CH2CH2OCH3;⑧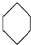 ;⑨CH2=CH-CH=CH2; ⑩CH2=CH-CH2CH2CH3
;⑨CH2=CH-CH=CH2; ⑩CH2=CH-CH2CH2CH3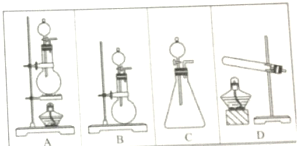 实验室里现有下列装置和试剂制取少量氯化氢气体时选用:①浓硫酸②浓盐酸③食盐固体④硫酸氢钠固体⑤二氧化锰固体请用实验装置编号回答:
实验室里现有下列装置和试剂制取少量氯化氢气体时选用:①浓硫酸②浓盐酸③食盐固体④硫酸氢钠固体⑤二氧化锰固体请用实验装置编号回答: