题目内容
13.常温下,将10.0mL 2.0mol•L-1的HNO3溶液加水稀释到400mL,所得HN03溶液的物质的量浓度为0.05mol•L-1.若从稀释后的溶液中取出100mL溶液,则溶液中含有HNO3的质量为0.315g,这100mL HN03溶液能中和62.5mL 0.08mol•L-1 Na0H溶液.分析 溶液稀释前后溶质的物质的量不变,则稀释后c(HN03)=$\frac{2.0mol/L×0.01L}{0.4L}$;若从稀溶液中取出100mL,则溶质的物质的量应该是总物质的量的$\frac{1}{4}$,根据m=nM计算取出溶液中溶质物质的量;硝酸和NaOH以1:1反应,即反应时存在n(HN03)=n(NaOH),根据V=$\frac{n}{c}$计算氢氧化钠溶液体积.
解答 解:溶液稀释前后溶质的物质的量不变,则稀释后c(HN03)=$\frac{2.0mol/L×0.01L}{0.4L}$=0.05mol/L;若从稀溶液中取出100mL,则溶质的物质的量应该是总物质的量的$\frac{1}{4}$=$\frac{1}{4}$×2.0mol/L×0.01L=0.005mol,m(HN03)=nM=0.005mol×63g/mol=0.315g;硝酸和NaOH以1:1反应,即反应时存在n(HN03)=n(NaOH)=0.005mol,V(NaOH)=$\frac{n}{c}$=$\frac{0.005mol}{0.08mol/L}$=0.0625L=62.5mL,故答案为:0.05;0.315;62.5.
点评 本题考查物质的量有关计算,明确溶液稀释前后溶质的物质的量不变是解本题关键,知道各个物理量之间关系即可解答,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
3.对达到平衡状态的可逆反应:A+B?C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是( )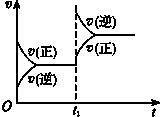

| A. | A、B都是气体,C、D都不是气体 | B. | A、B都是气体,C、D有一种是气体 | ||
| C. | C、D都是气体,A、B都是气体 | D. | C、D都是气体,A、B有一种是气体 |
18.完成下表:
| 物质 | 物质的量/mol | 体积(标况)/L | 分子数 | 质量 |
| H2 | 0.5 | |||
| CO2 | 44.8 | |||
| N2 | 6.02×1022 | |||
| O2 | 32 |
3.当a g NaHCO3和Na2CO3的混合物加热至质量不在减少时,变成b g,则原混合物中NaHCO3和Na2CO3的质量比应是( )
| A. | $\frac{a-b}{b}$ | B. | $\frac{b}{a-b}$ | C. | $\frac{b-0.63a}{a-b}$ | D. | $\frac{a-b}{b-0.63a}$ |
 ; ③CH3CH2-CH2-CH2OH;④CH3-C≡C-CH3;
; ③CH3CH2-CH2-CH2OH;④CH3-C≡C-CH3;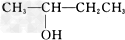 ;⑦CH3CH2CH2OCH3;⑧
;⑦CH3CH2CH2OCH3;⑧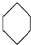 ;⑨CH2=CH-CH=CH2; ⑩CH2=CH-CH2CH2CH3
;⑨CH2=CH-CH=CH2; ⑩CH2=CH-CH2CH2CH3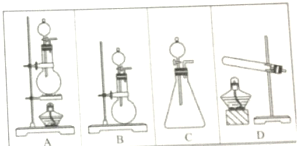 实验室里现有下列装置和试剂制取少量氯化氢气体时选用:①浓硫酸②浓盐酸③食盐固体④硫酸氢钠固体⑤二氧化锰固体请用实验装置编号回答:
实验室里现有下列装置和试剂制取少量氯化氢气体时选用:①浓硫酸②浓盐酸③食盐固体④硫酸氢钠固体⑤二氧化锰固体请用实验装置编号回答: