题目内容
14.下列关于甲烷的叙述中错误的是( )| A. | 甲烷分子具有正四面体结构,两个碳氢键之间的夹角为109°28′ | |
| B. | 甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子 | |
| C. | 甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 | |
| D. | “抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸 |
分析 甲烷为正四面体结构,两个碳氢键之间的夹角为109°28′,二氯取代物只有一种结构,甲烷是重要的化工原料,高温分解可生成炭黑和氢气,大量存在于坑道气中,以此解答.
解答 解:甲烷为正四面体结构,两个碳氢键之间的夹角为109°28′,甲烷是重要的化工原料,高温分解可生成炭黑和氢气,大量存在于坑道气中,燃烧生成二氧化碳和水,为清洁燃料,二氯取代物只有一种结构,只有B错误.
故选B.
点评 本题考查有机物的结构和性质,侧重于甲烷的考查,注意把握甲烷的结构、性质以及应用,注意相关知识的积累,难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
4.下列说法中正确的是( )
| A. |  与 与 互为同系物 互为同系物 | B. | 乙醇和乙醚互为同分异构体 | ||
| C. | 可用溴水来区分苯和苯的同系物 | D. | 乙醇、乙二醇、丙三醇互为同系物 |
5.苯环结构中不存在碳碳单键与碳碳双键的交替结构,可以作为证据的是( )
①苯不能使溴水褪色
②苯不能使酸性高锰酸钾溶液褪色
③苯在一定条件下既能发生取代反应,又能发生加成反应
④经测定,邻二甲苯只有一种结构
⑤经测定,苯环上碳碳键的键长相等,都是1.40×10-10m.
①苯不能使溴水褪色
②苯不能使酸性高锰酸钾溶液褪色
③苯在一定条件下既能发生取代反应,又能发生加成反应
④经测定,邻二甲苯只有一种结构
⑤经测定,苯环上碳碳键的键长相等,都是1.40×10-10m.
| A. | ①② | B. | ①②③ | C. | ①②③⑤ | D. | ①②④⑤ |
2. 空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
(1)一定条件下CO2可制得Na2CO3、NaHCO3等.
①等物质的量浓度的Na2CO3、NaHCO3溶液,碱性前者>后者(填“>”“<”或“=”).
②有下列五种物质的量浓度均为0.1mol/L的电解质溶液,将其稀释相同倍数时,pH变化最大的是E(填字母编号).
A.Na2CO3B.NaHCO3 C.NaAlO2 D.CH3COONa E.NaOH
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ/mol,测得在不同温度下,
该反应的平衡常数K随温度的变化如下:
上述反应中a>0(填“>”、“<”或“=”);在2L密闭容器中300℃下进行反应,若Fe和CO2的起始量均为4mol,当达到平衡时CO2的转化率为75%.
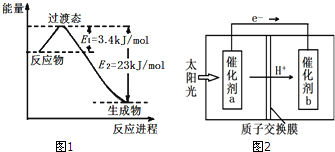
(3)目前工业上可以用CO2和H2在230℃、催化剂条件下反应生成甲醇蒸汽和水蒸气.图1为恒压容器中0.5mol CO2和1.5mol H2反应转化率达80%时的能量变化示意图.则该反应的热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49 kJ/mol.
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.图2是制备HCOOH的示意图,根据要求回答问题:
①催化剂b表面的电极反应式为CO2+2e-+2H+=HCOOH.
②经测定,若每分钟通过质子交换膜的H+的物质的量为40mol,则每小时可产生O219.2Kg.
 空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)一定条件下CO2可制得Na2CO3、NaHCO3等.
①等物质的量浓度的Na2CO3、NaHCO3溶液,碱性前者>后者(填“>”“<”或“=”).
②有下列五种物质的量浓度均为0.1mol/L的电解质溶液,将其稀释相同倍数时,pH变化最大的是E(填字母编号).
A.Na2CO3B.NaHCO3 C.NaAlO2 D.CH3COONa E.NaOH
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ/mol,测得在不同温度下,
该反应的平衡常数K随温度的变化如下:
| 温度(℃) | 300 | 500 | 700 |
| K | 3.00 | 3.47 | 4.40 |
(3)目前工业上可以用CO2和H2在230℃、催化剂条件下反应生成甲醇蒸汽和水蒸气.图1为恒压容器中0.5mol CO2和1.5mol H2反应转化率达80%时的能量变化示意图.则该反应的热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49 kJ/mol.
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.图2是制备HCOOH的示意图,根据要求回答问题:
①催化剂b表面的电极反应式为CO2+2e-+2H+=HCOOH.
②经测定,若每分钟通过质子交换膜的H+的物质的量为40mol,则每小时可产生O219.2Kg.
19.下表中,对陈述I、II的正确性及两者间有无因果关系的判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 用锌和足量稀硫酸制取氢气时加入硫酸铜溶液 | 可以加快制取氢气的速度 | Ⅰ对、Ⅱ对、无 |
| B | 用Mg-Al-NaOH构成原电池 | Mg更活泼作负极 | Ⅰ对、Ⅱ对、无 |
| C | 石墨常用做电解池的电极 | 石墨的化学性质稳定且导电性好 | Ⅰ对、Ⅱ对、有 |
| D | MgCl2是离子化合物 | 电解MgCl2的饱和溶液制取金属镁 | Ⅰ对、Ⅱ对、有 |
| A. | A | B. | B | C. | C | D. | D |
3.设NA是阿伏加德罗常数的数值.下列说法不正确的是( )
| A. | 7.8g Na2O2中含有的阴离子数目为0.1NA | |
| B. | 常温下,34gH2O2中H-O键数目为2NA | |
| C. | 1.00mol NaCl晶体中含有NA个NaCl分子 | |
| D. | 在20g D216O中含有10 NA个电子 |
4.有关l3C、15N的下列说法正确的是( )
| A. | 13C与15N有相同的中子数 | B. | 13C与C60互为同素异形体 | ||
| C. | 15N与14N互为同位素 | D. | 15N和14N的化学性质不同 |