题目内容
【题目】已知几种酸的电离常数如下:K(CH3COOH)=1.8×10-5; K1(H2CO3)=4.4×10-7;K2(H2CO3)=4.7×10-11;K(HClO)=4.0×10-8。
I.(1)常温下,0.1mol·L-1的下列三种溶液:①CH3COONa溶液 ②Na2CO3溶液 ③NaClO溶液, 其pH由大到小的顺序是________________(填序号);
(2)往NaClO溶液中通入少量CO2的离子反应方程式为___________________________________;
II. 常温下,在25.00 mL 0.1000 mol·L-1Na2CO3溶液中滴加0.1000 mol·L-1盐酸,溶液的pH变化曲线如图所示。
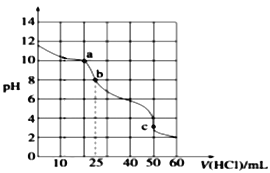
(3)a点溶液中c(CO32-) :c(HCO3-) =______________。
(4)b点溶液中溶质为______________。b点溶液呈碱性的原因为_______________________。
(5)b→c过程中的离子反应方程式为___________________________________________。
III. 现有某碳酸钠和氢氧化钠的混合溶液,为测定其中各成分的浓度,某实验小组设计了如下方案,步骤如下(结合上图回答下列问题):
①量取20.00mL样品溶液于锥形瓶中,加入几滴酚酞;
②用c mol·L-1的标准盐酸溶液滴定至终点;
③重复两次实验,消耗盐酸的体积平均值为V1 mL;
④另取20.00mL样品溶液于锥形瓶中,加入几滴甲基橙;
⑤用c mol·L-1的标准盐酸溶液滴定至终点;
⑥重复两次实验,消耗盐酸的体积平均值为V2 mL;
(6)步骤①中量取样品溶液所用仪器为___________________。
(7)步骤②终点现象为________________________________________________________________。
(8)样品溶液中碳酸钠和氢氧化钠物质的量浓度之比为___________。(用含c、V1、V2的式子表示),若步骤⑥中滴定结束时仰视读数,所得c(Na2CO3)_____(选填“偏大”、“偏小”、“不影响”)。
【答案】 ②③① CO2 + ClO- + H2O = HClO + HCO3- 0.47 NaHCO3 NaCl HCO3-水解程度大于其电离程度 H++ HCO3- = H2O + CO2↑ 碱式滴定管 滴入最后一滴盐酸,溶液由红色变为无色 (V2-V1)/(2V1-V2) 偏大
【解析】I.(1)根据几种酸的电离常数如下:K(CH3COOH)=1.8×10-5; K1(H2CO3)=4.4×10-7;K2(H2CO3)=4.7×10-11;K(HClO)=4.0×10-8可知,酸性:CH3COOH>H2CO3>HClO>HCO3-。酸性越强,水解程度越小,溶液的碱性越弱,常温下,0.1mol·L-1的①CH3COONa溶液 ②Na2CO3溶液 ③NaClO溶液,pH由大到小的顺序是②③①,故答案为:②③①;
(2)往NaClO溶液中通入少量CO2反应生成碳酸氢钠和次氯酸,反应的离子反应方程式为CO2 + ClO- + H2O = HClO + HCO3-,故答案为:CO2 + ClO- + H2O = HClO + HCO3-;
II.(3)a点溶液为碳酸钠、碳酸氢钠和氯化钠的混合物,K2(H2CO3) =4.7×10-11= =
=  ,解得
,解得 =0.47,故答案为:0.47;
=0.47,故答案为:0.47;
(4)b点恰好反应生成碳酸氢钠和氯化钠。碳酸氢钠水解程度大于电离程度,溶液显碱性,故答案为:NaHCO3 NaCl;HCO3-水解程度大于其电离程度;
(5)b点恰好反应生成碳酸氢钠和氯化钠,b→c过程中继续加入盐酸,碳酸氢钠与盐酸反应生成二氧化碳和水,反应的离子反应方程式为H++ HCO3- = H2O + CO2↑,故答案为:H++ HCO3- = H2O + CO2↑;
III.(6)碳酸钠和氢氧化钠的混合溶液显碱性,步骤①中量取样品溶液所用仪器为碱式滴定管,故答案为:碱式滴定管;
(7)用盐酸滴定碳酸钠和氢氧化钠溶液,选用酚酞作指示剂,滴定终点现象为滴入最后一滴盐酸,溶液由红色变为无色,故答案为:滴入最后一滴盐酸,溶液由红色变为无色;
(8)用酚酞作指示剂是滴定的物质为氢氧化钠,同时碳酸钠转化为碳酸氢钠,再用甲基橙作指示剂滴定碳酸钠和氢氧化钠,碳酸钠转化为二氧化碳,设样品溶液中碳酸钠和氢氧化钠物质的量分别为x、y,则x+y= c mol·L-1×V1 ×10-3L,2x+y= c mol·L-1×V2 ×10-3L,解得x= (c V2 ×10-3- c V1 ×10-3)mol,y=(2c V1 ×10-3- c V2 ×10-3)mol,碳酸钠和氢氧化钠物质的量浓度之比=物质的量之比=![]() ,若步骤⑥中滴定结束时仰视读数,导致消耗的盐酸体积偏大,即V2偏大,则x=(c V2 ×10-3- c V1 ×10-3)mol偏大,所得c(Na2CO3)偏大,故答案为:
,若步骤⑥中滴定结束时仰视读数,导致消耗的盐酸体积偏大,即V2偏大,则x=(c V2 ×10-3- c V1 ×10-3)mol偏大,所得c(Na2CO3)偏大,故答案为: ![]() ;偏大。
;偏大。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验现象描述正确的是( )
选项 | 实 验 | 现 象 |
A | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝箔滴落下来 |
C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D


