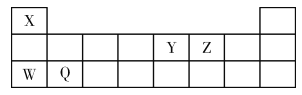
题目内容
【题目】酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇沸点低②乙醇密度比水小③乙醇有还原性④乙醇是烃的含氧衍生物⑤乙醇有刺激性气味
A.①③B.②③C.②④⑤D.①④
【答案】A
【解析】
橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+,Cr元素价态降低,被还原,说明K2Cr2O7是氧化剂,则乙醇是还原剂,具有还原性;呼出的气体中含有酒精,说明乙醇的沸点较低,易挥发,与测定原理有关的是①③。
答案选A。

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目