��Ŀ����
����Ŀ��(1)���������ʣ��������� ������ ��̼������ ����������
a.�ҳ������ε����ʣ�д������ˮ��Һ�еĵ��뷽��ʽ__________��
b.������������һ���������������ʾ��ܷ�Ӧ����������_________(�����)��
c.д������ϡ���ᷴӦ�����ӷ���ʽ������˫���ű������ת�����________��
(2)�����¼������ʣ���HCl���壬���������Һ����ͭ���ܶ�����̼���ݽ��ʯ�����������ƹ��壬�����ǣ���NaCl���壬�ᰱˮ��������KCl��
�����ܵ������___________________(����ţ���ͬ)��
�������ڵ���ʵ���_________________�����ڷǵ���ʵ���__________________��
(3)д����ҵ���Ʊ�Ư�۵Ļ�ѧ����ʽ_________________________________________��
���𰸡�NaHCO3��Na++HCO3�� �� 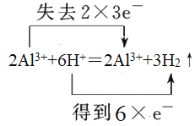 �ڢۢ�� �٢ޢ�� �ܢ� 2Cl2+2Ca(OH)2��CaCl2+Ca(ClO)2+2H2O
�ڢۢ�� �٢ޢ�� �ܢ� 2Cl2+2Ca(OH)2��CaCl2+Ca(ClO)2+2H2O
��������
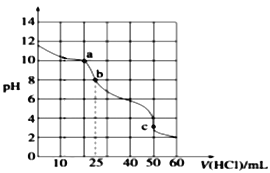
��1��a.�ɽ��������ӻ�笠����������������ɵĻ��������Σ��ݴ��жϣ�
b.�������ʵ����ʷ����жϣ�
c.����Al��HԪ�صĻ��ϼ۱仯��ϵ��ӵ�ʧ�غ������
��2���������ָ��ˮ��Һ����ۻ�״̬���ܹ�������������ӵĻ�����ǵ������ָ��ˮ��Һ�������״̬�¶�����������������ӵĻ�������������ƶ����ӻ����ӵ����ʿ��Ե��磻
��3��������ʯ���鷴Ӧ�Ʊ�Ư�ۡ�
��1�����������Ǽ���������������Ƕ�Ԫǿ�ᣬ��̼���������������ʽ�Σ�������������һԪǿ���
a.�����ε�������̼�����ƣ���ˮ��Һ�еĵ��뷽��ʽΪNaHCO3��Na++HCO3����
b.������ֻ�������ᷴӦ������������������̼�����ƺ��������Ʒ�Ӧ��̼������ֻ�������ᡢ�������Ʒ�Ӧ������������������һ���������������ʾ��ܷ�Ӧ�������������ᣬ��ѡ�ڡ�
c.�������ᷴӦ��������������������Ԫ�ػ��ϼ۴�0�����ߵ�+3�ۣ�ʧȥ3�����ӣ���Ԫ�ػ��ϼ۴�+1�۽��͵�0�ۣ��õ�1�����ӣ����ݵ��ӵ�ʧ�غ��֪����ת�����Ϊ ��
��
��2����HCl��������ˮ���Ե��磬�ǵ���ʣ�
���������Һ�к��������ƶ����������ӣ��ܵ��磬���ڻ������ǵ����Ҳ���Ƿǵ���ʣ�
��ͭ�ǽ������ʣ��ܵ��磬���ǵ����Ҳ���Ƿǵ���ʣ�
�ܶ�����̼�Ƿǵ���ʣ������磻
�ݽ��ʯ�ǵ��ʣ������磬���ǵ����Ҳ���Ƿǵ���ʣ�
���������ƹ����ǵ���ʣ������磻
�������Ƿǵ���ʣ������磻
��NaCl�����ǵ���ʣ������磻
�ᰱˮ�к��������ƶ����������ӣ��ܵ��磬���ڻ������ǵ����Ҳ���Ƿǵ���ʣ�
������KCl�к��������ƶ������ӣ��ܵ��磬�ǵ���ʡ�
�������ܵ�����Ǣڢۢ�⣻���ڵ���ʵ��Ǣ٢ޢ�⣻���ڷǵ���ʵ��Ǣܢߣ�
��3����ҵ���Ʊ�Ư�۵Ļ�ѧ����ʽΪ2Cl2+2Ca(OH)2��CaCl2+Ca(ClO)2+2H2O��