题目内容
3.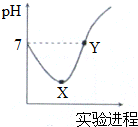 常温下,将Cl2缓慢通入一定量的蒸馏水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的NaOH溶液,整个过程中pH变化如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入一定量的蒸馏水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的NaOH溶液,整个过程中pH变化如图所示,下列叙述正确的是( )| A. | X、Y两点所示溶液中含有微粒的种类前者多 | |
| B. | X、Y两点所示溶液中水的电离程度前者大 | |
| C. | Y点所示溶液中存在c(Na+)=c(HClO)+2c(ClO-) | |
| D. | X点所示溶液中发生反应的离子方程式为Cl2+H2O═2 H++Cl-+ClO- |
分析 将Cl2缓慢通入一定量的蒸馏水中,发生反应:Cl2+H2O═HCl+HClO,由于反应生成酸,溶液pH降低,当氯水饱和时,溶液pH最小,即为图象中X点.然后滴加NaOH,发生反应:HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,溶液pH开始增大,由于滴加NaOH,可以看作先与HCl反应,然后再与HClO反应,当溶液pH=7时,即Y点溶液中溶质为NaCl、NaClO、HClO.
A.X点为氯水的饱和溶液,含有的微粒有Cl2、H2O、HClO、H+、Cl-、OH-、ClO-,Y点为NaCl、NaClO、HClO混合溶液,含有的微粒有H2O、HClO、Na+、H+、Cl-、OH-、ClO-;
B.X点含有盐酸、次氯酸,抑制水的电离;
C.Y点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),由电子转移守恒c(Cl-)=c(ClO-)+c(HClO),联立计算判断;
D.HClO为弱电解质,应写成化学式形式.
解答 解:将Cl2缓慢通入一定量的蒸馏水中,发生反应:Cl2+H2O═HCl+HClO,由于反应生成酸,溶液pH降低,当氯水饱和时,溶液pH最小,即为图象中X点.然后滴加NaOH,发生反应:HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,溶液pH开始增大,由于滴加NaOH,可以看作先与HCl反应,然后再与HClO反应,当溶液pH=7时,即Y点溶液中溶质为NaCl、NaClO、HClO.
A.X点为氯水的饱和溶液,含有的微粒有Cl2、H2O、HClO、H+、Cl-、OH-、ClO-,共有7种,Y点为NaCl、NaClO、HClO混合溶液,含有的微粒有H2O、HClO、Na+、H+、Cl-、OH-、ClO-,共有7种,含有微粒种类相同,故A错误;
B.Y点ClO-的水解程度与HClO的电离程度相同,而X点含有盐酸、次氯酸,抑制水的电离,故Y点所示溶液中水的电离程度较大,故B错误;
C.Y点溶液中溶质为NaCl、NaClO、HClO,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),由电子转移守恒c(Cl-)=c(ClO-)+c(HClO),所以c(Na+)=c(HClO)+2c(ClO-),故C正确;
D.HClO为弱电解质,应写成化学式形式,X点离子方程式为:Cl2+H2O=H++Cl-+HClO,故D错误,
故选C.
点评 本题综合考查氯气的性质、微粒浓度大小比较、弱电解质的电离等,侧重于学生的分析能力的考查,注意根据电荷守恒判断c(Cl-)=c(ClO-)+c(HClO),较运用物料守恒更直接,难度中等.

| A. | 1,2,3-丙三醇 | B. | 1-甲基-5-乙基苯 | ||
| C. | 3-甲基-2-乙基戊烷 | D. | 2-甲基-1,3-丁二烯 |
| A. | 被氧化的HCl为0.4mol | B. | 转移的电子数为0.2NA | ||
| C. | 该反应中HCl只作还原剂 | D. | Cl2为还原产物 |
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 标准状况下,11.2 LNH3中含有的电子数为5NA | |
| D. | 常温常压下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA |
| A. | 硝酸浓度越大,反应消耗的硝酸越少 | |
| B. | 硝酸浓度越大,产生的气体越少 | |
| C. | 硝酸浓度不同,生成Cu(NO3)2的物质的量不同 | |
| D. | 两者用排水法收集到气体体积相等 |
| A. | 纳米材料是指一种称为“纳米”的新物质制成的材料 | |
| B. | 绿色食品是指不含任何化学物质的食品 | |
| C. | 光导纤维是以二氧化硅为主要原料制成的 | |
| D. | 合成纤维的主要原料是石油、天然气、煤 |
| A. | 硅是良好的半导体材料,可以与NaOH 溶液和氢氟酸反应 | |
| B. | 二氧化硅与石灰石反应:SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO↑ | |
| C. | 用焦炭还原二氧化硅生产硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO2↑ | |
| D. | 工业制造镁粉是将镁蒸气在某气体中冷却,CO2可作为冷却气体. |
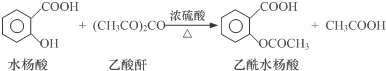
【反应原理】
【物质性质】
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | |
| 乙酸酐 | 139 | 在水中逐渐分解 | |
| 乙酰水杨酸 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
(1)物质制备:向125mL的锥形瓶中依次加入4g水杨酸、10mL乙酸酐、0.5mL浓硫酸,振荡锥形瓶至水杨酸全部溶解,在85℃~90℃条件下,用热水浴加热5~10min.
①加入水杨酸、乙酸酐后,需缓慢滴加浓硫酸,否则产率会大大降低,其原因是水杨酸属于酚类物质,会被浓H2SO4氧化.
②控制反应温度85℃~90℃的原因既保证有较高的反应速率又减少了物质的挥发.
(2)产品结晶:取出锥形瓶,加入50mL蒸馏水冷却.待晶体完全析出后用布氏漏斗抽滤,再洗涤晶体,抽干.简要叙述如何洗涤布氏漏斗中的晶体?向布氏漏斗中加入冰水至浸没所有晶体,再抽滤,重复2~3次.
(3)产品提纯:将粗产品转移至150mL烧杯中,向其中慢慢加入试剂X并不断搅拌至不再产生气泡为止.进一步提纯最终获得乙酰水杨酸3.6g.
①试剂X为饱和碳酸钠溶液.
②实验中乙酰水杨酸的产率为69%(已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180).
(4)纯度检验:取少许产品加入盛有5mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色,其可能的原因是产品中仍然可能含有水杨酸.