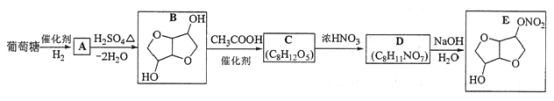
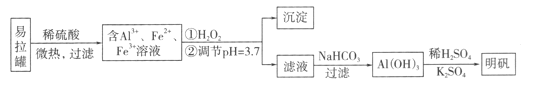
题目内容
【题目】向20mL某物质的量浓度的AlCl3溶液中滴加2mol/LNaOH溶液时,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如图所示。则:
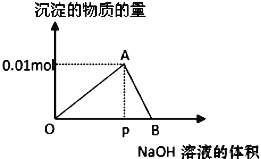
(1)写出OA段发生反应的离子方程式:OA段___,图中线段OP:PB=__,
(2)计算原AlCl3溶液的物质的量浓度为__mol/L,
(3)图中A对应的横坐标为__mL,
(4)当加入5mLNaOH溶液时,产生沉淀量为__mol,
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为__mL。
【答案】Al3++3OH﹣=Al(OH)3↓ 3:1 0.5 15 0.0033(或![]() ) 18.33(或
) 18.33(或![]() )
)
【解析】
向20mL某物质的量浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,逐滴加入NaOH溶液直至过量,过程中发生的反应为①Al3++3OH-=Al(OH)3↓,②Al(OH)3+OH-=AlO2-+2H2O,图象中OA段为发生反应①,AB段为氢氧化铝溶解发生反应②,依据各步反应分析判断,进行有关计算。
(1)依据分析可知OA段发生的反应是氯化铝和氢氧化钠反应生成氢氧化铝沉淀至最大量的过程,反应离子方程式为:Al3++3OH-=Al(OH)3↓; AB段发生的是氢氧化铝溶解在氢氧化钠溶液中至沉淀全部溶解,根据反应①Al3++3OH-=Al(OH)3↓,②Al(OH)3+OH-=AlO2-+2H2O得到生成最大量沉淀和沉淀全部溶解所消耗氢氧化钠物质的量之比为3:1,氢氧化钠溶液浓度一定,所以消耗的NaOH溶液体积比为3:1,
故答案为:Al3++3OH-=Al(OH)3↓;3:1;
(2)图象中分析得到最大量氢氧化铝沉淀物质的量为0.01mol,根据Al守恒,所以氯化铝物质的量为0.01mol,氯化铝溶液浓度=![]() =0.5mol/L,
=0.5mol/L,
故答案为:0.5;
(3)图象中分析得到最大量氢氧化铝沉淀物质的量为0.01mol,所以消耗氢氧化钠物质的量为0.03mol,氢氧化钠溶液的体积=![]() =
=![]() =0.015L=15mL,
=0.015L=15mL,
故答案为:15;
(4)当加入5mLNaOH溶液时,产生沉淀量依据反应Al3++3OH-=Al(OH)3↓;计算得到:
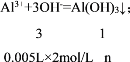
n=0.0033mol(或![]() mol),
mol),
故答案为:0.0033(或![]() );
);
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,则发生反应Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,最大量沉淀为0.01mol,消耗氢氧化钠物质的量为0.03mol,溶解的沉淀物质的量=0.01mol0.0033mol=0.0067mol,溶解0.0067mol氢氧化铝消耗氢氧化钠为0.0067mol;所以共消耗氢氧化钠物质的量=0.0067mol+0.03mol=0.0367mol;需要氢氧化钠溶液体积=![]() =0.01833L=18.35mL[或
=0.01833L=18.35mL[或![]() mL(依据沉淀量为
mL(依据沉淀量为![]() mol计算)];
mol计算)];
故答案为:18.35(或![]() )。
)。