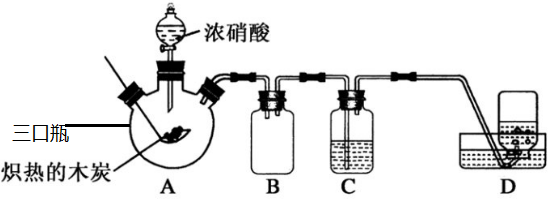
题目内容
14. 向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断正确的是(不计CO2溶解)( )
向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断正确的是(不计CO2溶解)( )| A. | 若OB=0,则溶液M为Na2CO3溶液 | |
| B. | 若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2═HCO3- | |
| C. | 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3) | |
| D. | 若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3- |
分析 CO2与NaOH反应为①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H20,
当$\frac{n(C{O}_{2})}{n(NaOH)}$≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
当$\frac{1}{2}$<$\frac{n(C{O}_{2})}{n(NaOH)}$<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
当$\frac{n(C{O}_{2})}{n(NaOH)}$≤$\frac{1}{2}$,反应按②进行,等于$\frac{1}{2}$时,CO2、NaOH恰好反应生成Na2CO3;小于$\frac{1}{2}$时,生成Na2CO3,NaOH有剩余;
向M中逐滴加入盐酸,根据溶液M中溶质不同,通过反应过程判断.
解答 解:由分析可知向NaOH溶液中通入CO2气体后得溶液M中溶质情况有:
(1)当含有两种溶质时,
①若溶质为Na2CO3、NaOH时,不能立即产生气体,滴加盐酸先中和氢氧化钠,然后与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积同碳酸氢钠与盐酸反应生成二氧化碳所消耗的盐酸体积相等,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为 ;
;
②若为NaHCO3、Na2CO3,不能立即产生气体,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积小于与碳酸氢钠反应生成二氧化碳所消耗的盐酸体积,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为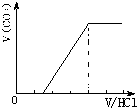 ;
;
(2)若只有一种溶质时,
①当溶质为Na2CO3时,不能立即产生气体,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积等于与碳酸氢钠反应生成二氧化碳所消耗的盐酸体积,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为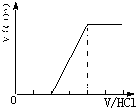 ;
;
②当溶质为NaHCO3时,滴加盐酸与碳酸氢钠反应生成二氧化碳,立即产生气体,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为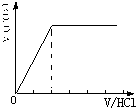 .
.
A.若OB=0,则形成溶液M所发生反应的离子方程式为OH-+CO2═HCO3-,则溶液M为NaHCO3溶液,故A错误;
B.若OB=BC,M溶质为Na2CO3,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积等于与碳酸氢钠反应生成二氧化碳所消耗的盐酸体积,形成溶液M所发生反应的离子方程式为2OH-+CO2═CO32-+H2O,故B错误;
C.若3OB=BC,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,则溶液M中c(NaHCO3)=2c(Na2CO3),故C正确;
D.若OB>BC,则溶液M中大量存在的阴离子为CO32-和OH-,故D错误;
故选C.
点评 本题考查混合物的有关计算,难度中等,关键判断溶液可能的溶质,分情况讨论.注意盐酸的体积.

| A. | 将SO2通入品红溶液中 | B. | 将Cl2通入KI溶液中 | ||
| C. | 将SO2通入溴水中 | D. | 将H2S通入硝酸溶液中 |
| 选项 | 实验方法 | 现象 | 结论 |
| 向某溶液加入AgNO3溶液 | 出现白色沉淀 | 原溶液中一定有Cl- | |
| 向某溶液加入BaCl2溶液 | 出现白色沉淀 | 原溶液中一定有SO42- | |
| 向某溶液加入NaOH溶液 | 出现蓝色沉淀 | 原溶液中一定有Cu2+ | |
| 向某溶液加入H2SO4溶液 | 产生无色无味气体 | 原溶液中一定有CO32- |
| A. | A | B. | B | C. | C | D. | D |
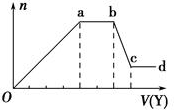 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(1)若Y是盐酸,则X溶液中一定含有的离子是SiO32-、AlO2-、CO32-、Na+,ab段发生反应的总离子方程式为CO32-+2H+=H2O+CO2↑,图中Oa段与Y溶液反应的离子的物质的量之比为【要标明离子符号,如n(Na+)】.
(2)若Y是NaOH溶液,则ab段反应的离子方程式为NH4++OH-═NH3•H2O; bc段反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.若不考虑离子的水解因素,忽略H+和OH-,且溶液中只存在4种离子,则它们的离子个数比为【要标明离子符号,如n(Na+),按阳离子在前,阴离子在后,高价在前,低价在后得顺序排列】.
| A. |  用图所示装置氧化Br- | |
| B. | 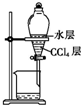 用图所示装置萃取Br2 | |
| C. | 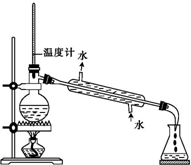 用图所示装置分离CCl4和Br2 | |
| D. | 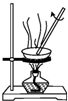 用图所示的装置将含AlCl3的溶液蒸发制取无水AlCl3 |
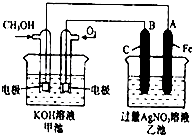 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白:
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白: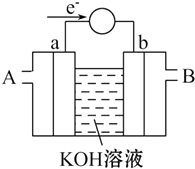 能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ/mol、282.5kJ/mol、726.7kJ/mol.请回答:
能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ/mol、282.5kJ/mol、726.7kJ/mol.请回答: