题目内容
5.下列化学用语正确的是( )| A. | 硅的原子结构示意图: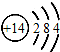 | |
| B. | 原子核内有8个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 二氧化碳分子的电子式: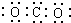 | |
| D. | 甲烷分子的比例模型: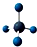 |
分析 A.硅原子的核电荷数为14,核外电子数为14,最外层为4个电子;
B.氧元素的质子数为8,中子数为8的氧原子的质量数为16;
C.二氧化碳分子中含有两个碳氧双键,不是单键;
D. 为甲烷的球棍模型,不是比例模型.
为甲烷的球棍模型,不是比例模型.
解答 解:A.硅原子的原子序数=核外电子总数=14,硅的原子结构示意图为: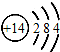 ,故A正确;
,故A正确;
B.原子核内有8个中子的氧原子的质量数为16,该氧原子的正确表示方法为:816O,故B错误;
C.二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,正确的电子式为: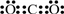 ,故C错误;
,故C错误;
D.甲烷分子的比例模型应该体现出甲烷分子中各原子的相对体积大小,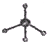 为甲烷的球棍模型,甲烷的比例模型为:
为甲烷的球棍模型,甲烷的比例模型为: ,故D错误;
,故D错误;
故选A.
点评 本题考查了电子式、元素符号、球棍模型与比例模型、原子结构示意图等化学用语的判断,题目难度中等,注意掌握常见化学用语的表示方法,明确球棍模型与比例模型、原子结构示意图与离子结构示意图的区别.

练习册系列答案
相关题目
15.甲、乙、丙均为中学化学常见的不同物质,它们的转化关系如图所示:
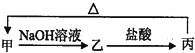
其中甲不可能是( )

其中甲不可能是( )
| A. | SiO2 | B. | SO2 | C. | NH4Cl | D. | Al2O3 |
16.下列元素或物质性质的比较中,正确的是( )
| A. | 元素的最高正化合价:N>S | B. | 热稳定性:HCl>HI | ||
| C. | 碱性:Mg(OH)2>NaOH | D. | 酸性:H2SiO3>H2CO3 |
13.如图所示,在常温下,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )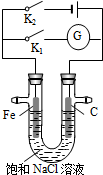

| A. | K1闭合,铁棒上发生的反应为2H++2e-═H2↑ | |
| B. | K1闭合,石墨棒周围溶液pH逐渐降低 | |
| C. | K2闭合,铁棒不易被腐蚀,电路中通过0.001NA个电子时,摇匀后溶液的pH为11 | |
| D. | K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002mol气体 |
20.下列反应属于取代反应的是( )
| A. | 苯与溴水混合后振荡,水层褪色 | |
| B. | 乙烯通入酸性KMnO4溶液中,溶液褪色 | |
| C. | CH4与Cl2的混合气体光照后颜色变浅 | |
| D. | 乙烯通入溴水中,溴水褪色 |
10.下列化合物的化学键中,只有离子键的是( )
| A. | NH4Cl | B. | Na2CO3 | C. | MgCl2 | D. | K2SO4 |
14.依照阿佛加德罗定律,下列叙述错误的是( )
| A. | 同温同压下两种气体的体积之比等于物质的量之比 | |
| B. | 同温同压下两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下两种气体的摩尔质量之比等于密度之比 | |
| D. | 同温同体积下两种气体的物质的量之比等于压强之比 |
20.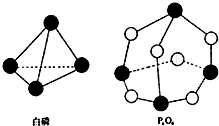 化学反应的本质是旧健的断裂和新键的形成过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198 P-O:360 O=O:498,则反应P4(白磷)+3O2→P4O6的能量变化为( )
化学反应的本质是旧健的断裂和新键的形成过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198 P-O:360 O=O:498,则反应P4(白磷)+3O2→P4O6的能量变化为( )
 化学反应的本质是旧健的断裂和新键的形成过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198 P-O:360 O=O:498,则反应P4(白磷)+3O2→P4O6的能量变化为( )
化学反应的本质是旧健的断裂和新键的形成过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198 P-O:360 O=O:498,则反应P4(白磷)+3O2→P4O6的能量变化为( )| A. | 吸收126kJ的能量 | B. | 释放126kJ的能量 | ||
| C. | 吸收1638kJ的能量 | D. | 释放1638kJ的能量 |