题目内容
已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )
| A.吸热88kJ | B.吸热2.44KJ | C.放热44kJ | D.吸热44KJ |
B
根据盖斯定律可知,①+②即得到H2O(g)=H2O(1),所以该过程中的能量变化是+241.8kJ/mol-285.8kJ/mol=-44kJ/mol,即气态水变成液态水是放热的过程。所以当1g液态水变为水蒸气时,应该吸热是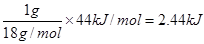 ,答案选B。
,答案选B。
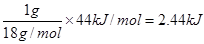 ,答案选B。
,答案选B。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 N2(g)+
N2(g)+ H2(g)=NH3(1);△H=(b+c-a)kJ·mol-1
H2(g)=NH3(1);△H=(b+c-a)kJ·mol-1
 CO(g)+3H2(g),该反应的ΔH="+206" kJ?mol-1将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结果保留两位有效数字)
CO(g)+3H2(g),该反应的ΔH="+206" kJ?mol-1将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结果保留两位有效数字) Fe(s)+CO2(g)△H="a" kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是
Fe(s)+CO2(g)△H="a" kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是 CH3OH(g)。
CH3OH(g)。