题目内容
已知下列热化学方程式:Zn(s) + 1/2O2(g) = ZnO(s) △H=" -" 351.1kJ/mol
Hg(l) + 1/2O2(g) = HgO(s) △H=" -" 90.7kJ/mol
由此可知反应 Zn(s) + HgO(s) =" ZnO(s)" + Hg(l) 的焓变为
Hg(l) + 1/2O2(g) = HgO(s) △H=" -" 90.7kJ/mol
由此可知反应 Zn(s) + HgO(s) =" ZnO(s)" + Hg(l) 的焓变为
-260.4kJ/mol (2分)
试题分析:根据盖斯定律可知,①-②即得到Zn(s) + HgO(s) =" ZnO(s)" + Hg(l),所以该反应的焓变是△H=-351.1kJ/mol+90.7kJ/mol=-260.4kJ/mol。
点评:反应热的有关计算一般可以根据能量守恒定律,然后借助于盖斯定律进行。

练习册系列答案
相关题目
 H=-67.7 kJ·mol-1
H=-67.7 kJ·mol-1 F-(aq)+H+(aq)
F-(aq)+H+(aq)  CH4(g)+O2(g)=
CH4(g)+O2(g)=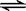 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( ) 2NH3(g)△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是
2NH3(g)△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是 H+ + CN-, K(1)Θ =" 4.9" ×10-10
H+ + CN-, K(1)Θ =" 4.9" ×10-10