题目内容
(14分)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图所示。

(1)在0-30小时内,CH4的平均生成速率vⅠ、vⅡ和vⅢ从大到小的顺序为 ;
反应开始后的12小时内,在第 种催化剂的作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),该反应的ΔH="+206" kJ?mol-1将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结果保留两位有效数字)
CO(g)+3H2(g),该反应的ΔH="+206" kJ?mol-1将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结果保留两位有效数字)
(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802kJ?mol-1
写出由CO2生成CO的热化学方程式

(1)在0-30小时内,CH4的平均生成速率vⅠ、vⅡ和vⅢ从大到小的顺序为 ;
反应开始后的12小时内,在第 种催化剂的作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)
 CO(g)+3H2(g),该反应的ΔH="+206" kJ?mol-1将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结果保留两位有效数字)
CO(g)+3H2(g),该反应的ΔH="+206" kJ?mol-1将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结果保留两位有效数字)(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802kJ?mol-1
写出由CO2生成CO的热化学方程式
(1)VⅢ>VⅡ> VⅠ;Ⅱ。 (2)三步计算可求CH4的转化率为:0.1/0.11=0.91
(3)CO2(g) +3H2O(g) =2O2(g) +CO(g)+3H2(g) △H="+1008" kJ?mol-1
(3)CO2(g) +3H2O(g) =2O2(g) +CO(g)+3H2(g) △H="+1008" kJ?mol-1
试题分析:(1)由图像可以看出,反应进行到30小时时,催化剂Ⅲ生成的甲烷最多,其次是催化剂Ⅱ,催化剂Ⅰ生成的甲烷最少。因此VI、VII和VIII从大到小的顺序为VIII>VII>VI>;同理由图像也可以看出,反应进行到12小时时,催化剂Ⅱ生成的甲烷最多,因此在第Ⅱ种催化剂的作用下,收集的CH4最多。
(2)设CH4、H2O的物质的量均为xmol,则
CH4(g) + H2O(g)
 CO(g) + 3H2(g)
CO(g) + 3H2(g)起始量(mol) x x 0 0
变化量(mol) 0.10 0.10 0.10 0.30
平衡量(mol) x- 0.10 x- 0.10 0.10 0.30
根据题意,则平衡常数K=c(CO)·c3(H2)/[c(CH4)·c(H2O)]=(0.10mol·L-1)·(0.30mol·L-1)3/[(x-0.10)mol·L-1·(x- 0.10)mol·L-1]=27(mol·L-1)2,则x=0.11mol,所以CH4的转化率为0.1/0.11=0.91。
(3)由热化学方程式①CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH="+206" kJ?mol-1②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802kJ?mol-1,①-②得CO2(g) +3H2O(g) =2O2(g) +CO(g)+3H2(g) △H="+1008" kJ?mol-1。
CO(g)+3H2(g) ΔH="+206" kJ?mol-1②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802kJ?mol-1,①-②得CO2(g) +3H2O(g) =2O2(g) +CO(g)+3H2(g) △H="+1008" kJ?mol-1。点评:本题综合性强,是高考中的热点考题,主要考查学生的分析问题,解决问题的能力。

练习册系列答案
相关题目
 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol 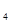 +5O
+5O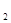 =P
=P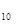 。已知断裂下列化学键需要吸收的能量分别为:P-Pa kJ·mol
。已知断裂下列化学键需要吸收的能量分别为:P-Pa kJ·mol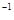 、P-O b kJ·mol
、P-O b kJ·mol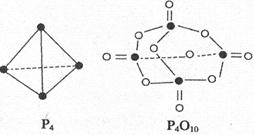
 CH4(g)+O2(g)=
CH4(g)+O2(g)=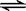 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )