题目内容
(6分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
CO(g) + 2H2(g) CH3OH(g)。
CH3OH(g)。
⑴该反应的平衡常数表达式为 K = ___________________________。
⑵如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变△H _____0(填“>”、“<”或“=”)。
②若容器容积不变,下列措施可增加甲醇产率的是_________。
⑶已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) △H=-a kJ·mol-1
② 2CO(g) + O2(g) = 2CO2(g) △H=-b kJ·mol-1
③ H2O(g) = H2O(l) △H=-c kJ·mol-1
则CH3OH(l) + O2(g) =" CO(g)" + 2H2O(l) △H= ____________________ kJ·mol-1。
CO(g) + 2H2(g)
 CH3OH(g)。
CH3OH(g)。⑴该反应的平衡常数表达式为 K = ___________________________。
⑵如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变△H _____0(填“>”、“<”或“=”)。
②若容器容积不变,下列措施可增加甲醇产率的是_________。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.使用合适的催化剂 | D.充入He,使体系总压强增大 |
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) △H=-a kJ·mol-1
② 2CO(g) + O2(g) = 2CO2(g) △H=-b kJ·mol-1
③ H2O(g) = H2O(l) △H=-c kJ·mol-1
则CH3OH(l) + O2(g) =" CO(g)" + 2H2O(l) △H= ____________________ kJ·mol-1。
⑴  (2分)
(2分)
⑵ <(1分) B (1分) ⑶ (2分)
(2分)
 (2分)
(2分)⑵ <(1分) B (1分) ⑶
 (2分)
(2分)(1)平衡常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是 。
。
(2)(2)①根据图像可知,T2大于T1,升高温度,CO的转化率是降低的,所以正反应是放热反应,即△H小于0。
②升高温度,平衡向逆反应方向进行,A不正确;催化剂不能改变平衡状态,C不正确;充入He,使体系总压强增大,但浓度是不变的,所以平衡不移动,答案选B。
(3)根据盖斯定律可知,(①+④×4-②)÷2即得到CH3OH(l) + O2(g) =" CO(g)" + 2H2O(l),所以该反应的△H= mol。
mol。
 。
。(2)(2)①根据图像可知,T2大于T1,升高温度,CO的转化率是降低的,所以正反应是放热反应,即△H小于0。
②升高温度,平衡向逆反应方向进行,A不正确;催化剂不能改变平衡状态,C不正确;充入He,使体系总压强增大,但浓度是不变的,所以平衡不移动,答案选B。
(3)根据盖斯定律可知,(①+④×4-②)÷2即得到CH3OH(l) + O2(g) =" CO(g)" + 2H2O(l),所以该反应的△H=
 mol。
mol。
练习册系列答案
相关题目
 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol 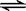 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( ) H+ + CN-, K(1)Θ =" 4.9" ×10-10
H+ + CN-, K(1)Θ =" 4.9" ×10-10