题目内容
已知化学反应:①C(s)+1/2O2(g) = CO(g) △H1<0
②CO(g) +1/2O2(g) = CO2(g) △H2<0
③C(s)+O2(g) = CO2(g) △H3<0;
相同条件下,下列说法正确的是
②CO(g) +1/2O2(g) = CO2(g) △H2<0
③C(s)+O2(g) = CO2(g) △H3<0;
相同条件下,下列说法正确的是
| A.56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量 |
| B.反应②反应物的键能之和大于产物键能之和 |
| C.△H1+△H2>△H3 |
| D.△H3 >△H1 ,故CO2比CO稳定 |
A
反应式放热反应,所以反应前的总能量高于生成物的总能量,选项A正确;断键吸收的总能量和形成化学键所放出的总能量的差值是反应热,所以选项B不正确,应该是小于;根据盖斯定律可知,①+②即得到反应③,所以△H1+△H2=△H3,C不正确;碳完全燃烧放出的热量多,但放热越多,△H越小,所以△H3 <△H1 ,选项D不正确,答案选A。

练习册系列答案
相关题目
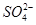 (aq)+
(aq)+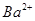 (aq)+2
(aq)+2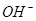 (aq) = BaSO4(s)+2H
(aq) = BaSO4(s)+2H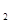 O(l);
O(l);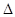 H =
H =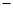 57.3 kJ/mol
57.3 kJ/mol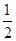 H
H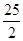 O
O CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
CO2(g) + H2(g) △H1=" +" 41.2kJ/mol H2(g)+CO(g)表 ΔH=+131.3 kJ,ΔS=+133.7 J/K
H2(g)+CO(g)表 ΔH=+131.3 kJ,ΔS=+133.7 J/K O2(g)==H2O(g) △H1 N2(g)+2O2==2NO2(g) △H2
O2(g)==H2O(g) △H1 N2(g)+2O2==2NO2(g) △H2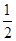 N2(g)+
N2(g)+ H2(g)==NH3(g) △H3
H2(g)==NH3(g) △H3