题目内容
NA为阿伏加德罗常数的数值,下列说法中正确的是
| A.在密闭容器中加入1.5molH2和0.5molN2,充分反应后可得NH3分子数目为NA |
| B.1.0L 0.1mol?L—1Na2CO3溶液中含有的CO32—离子数目为0.1NA |
| C.一定条件下,2.3gNa完全与O2反应生成3.6g产物时失去电子数目为0.1NA |
| D.在标准状况下,2.24L的CH3CH2OH含有NA个分子 |
C
解析试题分析:A.不正确,lH2和N2的反应是可逆反应,得到NH3分子数目少于NA;B.不正确,CO32―水解,1.0L 0.1mol?L—1Na2CO3溶液中含有的CO32—离子数目少于0.1NA;C.正确;D.不正确,在标准状况下,2.24L的CH3CH2OH是液体。选C。
考点:阿伏加德罗常数

 一本好题口算题卡系列答案
一本好题口算题卡系列答案下列说法正确的是:
①Cl-的结构示意图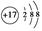 ;
;
②羟基的电子式: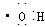 ;
;
③HClO的结构式:H—Cl—O;
④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-;
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质;
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化( )
| A.①②⑤ | B.①④⑥⑦ | C.②③④⑥ | D.②③⑤⑥⑦ |
将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气 L L |
B.反应后溶液中的Cl―数目为: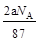 |
C.NA可表示为: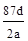 |
D.反应后溶液中的H+数目为: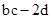 |
在某溶液中仅存在NH4+、Fe3+、SO42—三种离子,已知NH4+和SO42—个数比为3︰2,则NH4+、Fe3+、SO42—三种离子的个数比为
| A.6︰1︰9 | B.3︰1︰2 | C.1︰1︰1 | D.9︰1︰6 |
同温同压下,等质量的下列气体所占有的体积最大的是
| A.O2 | B.CH4 | C.CO2 | D.SO2 |
在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·mL-1,质量分数为w,其中含有NH4+的物质的量是b mol,下列叙述正确的是( )
A.溶质的质量分数w=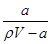 ×100% ×100% |
B.溶质的物质的量浓度c= mol·L-1 mol·L-1 |
C.溶液中c(OH-)=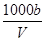 mol·L-1+c(H+) mol·L-1+c(H+) |
| D.向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w |
两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况)。则原混合物中Na2O2和NaHCO3的物质的量之比为
| A.3:2 | B.2:1 | C.8:1 | D.2:9 |
下列说法正确的是
| A.相同物质的量的O2和O3,体积相同 |
| B.离子化合物一定含有离子键,可能含有共价键 |
| C.由盐酸的酸性强于氢硫酸的酸性,可推知氧化性:Cl2>S |
| D.常温下,等体积、pH均为3的醋酸和硫酸分别与完全相同的镁条反应,硫酸产生氢气速率快 |
1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.2mol/L。若向该混合溶液中加入足量的铜粉。则最多能溶解铜粉的质量为
| A.2.4 g | B.3.2 g | C.6.4 g | D.9.6 g |