题目内容
两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况)。则原混合物中Na2O2和NaHCO3的物质的量之比为
| A.3:2 | B.2:1 | C.8:1 | D.2:9 |
CD
解析试题分析:两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出0.1mol的气体,有二氧化碳气体和氧气;将这些气体通入另一份混合物中,发生反应:2Na2O2+2CO2=2Na2CO3+O2 ↑,每消耗2mol二氧化碳气体,气体总体积减少1mol,现在气体减少了0.01mol,则参加反应的二氧化碳气体为0.02mol,生成的氧气为0.08mol,从而算出过氧化钠0.16mol,碳酸氢钠物质的量为0.02mol,则比值为8:1。
考点:考查物质的化学性质及相关计算。

练习册系列答案
相关题目
对下列化学用语的理解和描述均正确的是
A.原子结构示意图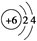 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
B.比例模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C.结构示意图为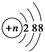 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
D.电子式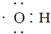 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
在无土栽培液中,每升溶液需用0.98mol NH4Cl溶液、0.16 mol KCl溶液、0.24molK2SO4溶质作为培养液,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,所需三种盐的物质的量是
| A.0.4mol、0.5mol、0.12mol |
| B.0.66mol、0.5mol、0.24mol |
| C.0.64mol、0.5mol、0.24mol |
| D.0.64mol、0.02mol、0.24mol |
NA为阿伏加德罗常数的数值,下列说法中正确的是
| A.在密闭容器中加入1.5molH2和0.5molN2,充分反应后可得NH3分子数目为NA |
| B.1.0L 0.1mol?L—1Na2CO3溶液中含有的CO32—离子数目为0.1NA |
| C.一定条件下,2.3gNa完全与O2反应生成3.6g产物时失去电子数目为0.1NA |
| D.在标准状况下,2.24L的CH3CH2OH含有NA个分子 |
下列化学用语表示正确的是
A.CO2的比例模型: |
B.铝离子的结构示意图: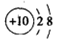 |
| C.次氯酸的结构式:H-Cl-O |
D.甲基的电子式: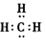 |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,224mL水含有的电子数为0.1NA |
| B.1L 0.1mol/L硅酸钠溶液中含有0.1NA个SiO32- |
| C.足量的铁粉与lmolCl2在加热条件下充分反应,转移的电子数为3NA |
| D.标准状况下,11.2LCO2和SO2混合气体中含NA个氧原子 |
NA为阿伏伽德常数,则下列说法正确的是
| A.在标准状况下,11.2LSO3分子中含有2NA个原子 |
| B.100mL0.1/L的Na2CO3溶液中含有0.01NA个CO32- |
| C.22.4LCl2通入水中充分反应,共转移NA个电子. |
| D.在标准状况下,11.2L的N2和H2组成的混合气中共有NA个原子 |
下列说法正确的是
| A.7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023 |
| B.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0×6.02×1023 |
| C.2.24LSO2与O2混合气体中所含氧原子数为0.2×6.02×1023 |
| D.Vlamol·L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
有关碳元素及其化合物的化学用语正确的是
A.CO2的电子式: |
B.C原子最外层电子的轨道表示式: |
| C.醋酸钠的分子式:C2H3O2Na |
D.乙烯的比例模型: |