题目内容
20.将标准状况的NO2、NH3、N2组成的混合气体10L,通过稀HNO3溶液,溶液的质量增加了12.5g,气体的体积缩小到3.28L.求混合气体各成分的体积.分析 稀硝酸质量增加的部分为氨气和部分二氧化氮,设出氨气和二氧化氮的物质的量,根据质量关系列出方程式①;最终气体为氮气和NO,利用体积关系列出方程式②,然后联立①②即可得出氨气和二氧化氮的物质的量,再根据V=nVm计算出氨气和二氧化氮的体积,最后得出氮气的体积.
解答 解:稀硝酸吸收氨气和NO2,同时放出NO气体,
设NH3为xmol,NO2为y mol,则生成y3molNO,
则溶液增加的质量为:①17x+46y-30×y3=12.5g,
根据氮气的体积可知:②10-22.4(x+y)=3.28-22.4×y3,
联立①②解得:x=0.1 mol、y=0.3 mol,
所以混合体中NO2体积为:22.4L/mol×0.3mol=6.72L,NH3体积为:22.4L/mol×0.1mol=2.24L,N2体积为:10L-6.72L-2.24L=1.04L,
答:混合气体中含有6.72L二氧化氮、2.24L氨气和1.04L氮气.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握质量守恒定律在化学计算中的应用,试题充分考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
11.硒(Se)是人体必需的微量元素,与O同主族,Se原子比O原子多两个电子层,该族2~5周期元素单质分别与H2反应生成lmol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是( )
| A. | -241.8 kJ•mol-1 | B. | -20.6kJ•mol-1 | C. | +29.7kJ•mol-1 | D. | +99.7 kJ•mol-1 |
8.家用炒菜铁锅用水清洗放置后,常出现红棕色的锈斑.在此过程中不发生的化学反应是( )
| A. | Fe-3e-=Fe3+ | B. | 2Fe+2H2O+O2=2Fe(OH)2↓ | ||
| C. | 2H2O+O2+4e-=4OH- | D. | 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
12.下列离子方程式正确的是( )
| A. | FeBr2溶液中滴入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| B. | 酸性条件下,FeSO4溶液与H2O2反应:Fe2++2H++H2O2=Fe3++2H2O | |
| C. | SO2通入Ca(ClO)2溶液中:Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO | |
| D. | NaAlO2溶液与NaHCO3溶液混合:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- |
11.下列化学用语中,正确的是( )
| A. | 四氯化碳的电子式: | |
| B. | 镁的原子结构示意图为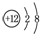 | |
| C. | 氯化氢分子的形成过程可用电子式表示为:H×+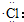 →H+[ →H+[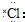 ]- ]- | |
| D. | 重水的化学式为21H2O(或D2O) |
12.下列各反应中属于加成反应的是( )
| A. | C2H4+3O2点燃→2CO2+2H2O | |
| B. | H2+Cl2光照→2HCl | |
| C. | CH2=CH2+Br2→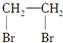 | |
| D. | CH3-CH3+2Cl2催化剂→CH2Cl-CH2Cl+2HCl |