题目内容
12.下列离子方程式正确的是( )| A. | FeBr2溶液中滴入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| B. | 酸性条件下,FeSO4溶液与H2O2反应:Fe2++2H++H2O2=Fe3++2H2O | |
| C. | SO2通入Ca(ClO)2溶液中:Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO | |
| D. | NaAlO2溶液与NaHCO3溶液混合:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- |
分析 A.氯气过量,溴离子和亚铁离子都完全被氧化,溴离子的计量数错误;
B.离子方程式两边正电荷不相等,不满足电荷守恒;
C.亚硫酸钙被次氯酸氧化成硫酸钙;
D.碳酸氢根离子的酸性大于氢氧化铝,二者反应生成氢氧化铝沉淀和碳酸钠.
解答 解:A.FeBr2溶液中滴入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,
B.酸性条件下,FeSO4溶液与H2O2反应生成硫酸铁,正确的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,故B错误;
C.向次氯酸钙溶液中通SO2气体,发生氧化还原反应生成硫酸钙、盐酸,正确的离子反应为:Ca2++ClO-+SO2+H2O═CaSO4↓+2H++Cl-,故C错误;
D.偏铝酸钠溶液与NaHCO3溶液混合,二者反应生成氢氧化铝沉淀,反应的离子方程式为:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
2.下列物质中,能使蛋白质变性的是( )
| A. | K2SO4 | B. | 福尔马林 | C. | NH4Cl | D. | Hg(NO3)2 |
3.水质检测的项目中不包含( )
| A. | 水温、pH | B. | 导电率、固体悬浮物 | ||
| C. | 氮的氧化物 | D. | DO、COD、BOD |
17.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4 g 金属镁变成镁离子时失去的电子数为 0.2 NA | |
| B. | 标准状况下,18 g H2O中含有NA个水分子 | |
| C. | 常温常压下,11.2 L H2和O2的混合物所含分子个数是 0.5 NA | |
| D. | 1 mol/L NaOH溶液中含有的Na+数目是NA |
4.热化学方程式2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1中,化学式前面的化学计量数表示( )
| A. | 分子数 | B. | 体积 | C. | 质量 | D. | 物质的量 |


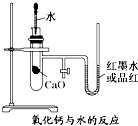 如图是某同学设计的放热反应的观察装置.
如图是某同学设计的放热反应的观察装置.