题目内容
5.“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出).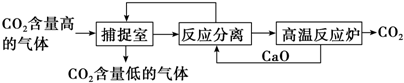
下列有关该方法的叙述中正确的是( )
①能耗大是该方法的一大缺点
②“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
③该方法可减少碳排放,捕捉到的CO2还可用来制备干冰等产品
④整个过程中,只有一种物质可以循环利用.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
分析 根据题中信息可知,基本过程中有两个反应:①二氧化碳与氢氧化钠反应,②碳酸钙的高温分解,循环利用的应该有CaO和NaOH两种物质,捕捉室中反应为二氧化碳与氢氧化钠反应,得到的Na2CO3和CaO在溶液中反应得到NaOH和CaCO3,以此解答.
解答 解:①碳酸钙的分解在高温条件下进行,消耗大量能量,是该方法的一大缺点,故①正确;
②“反应分离”过程中分离物质的操作应该是过滤,目的是通过过滤得到碳酸钙沉淀,故②错误;
③“碳捕捉技术,将二氧化碳转化为碳酸钙沉淀,可减少碳排放,捕捉到的CO2还可用来制备干冰等产品,故③正确;
④循环利用的有CaO和NaOH两种物质,故④错误;
故选B.
点评 本题考查了物质分离和提纯的实验方案设计,明确各个流程中发生的反应是解本题关键,注意从整体上把握,难度不大.

练习册系列答案
相关题目
16.氢气和一氧化碳混合气体100mL,完全燃烧,用去氧气50mL,则混合气体中CO和H2的体积比是( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 任意比 |
13.某人胃酸过多,并患有严重的胃溃疡,他选择的抗酸药可以是( )
| A. | 氢氧化铝 | B. | 碳酸氢钠 | C. | 阿司匹林 | D. | 麻黄碱 |
10.化学应用于生活中的点点滴滴,有关生活中的化学知识,下列说法中正确的是( )
①液氨可用作致冷
②生活中可以用“84”消毒液进行环境消毒
③Fe2O3常用作红色油漆和涂料
④二氧化硅是制备太阳能电池的主要原料
⑤SO2可用来漂白馒头、银耳等食品.
①液氨可用作致冷
②生活中可以用“84”消毒液进行环境消毒
③Fe2O3常用作红色油漆和涂料
④二氧化硅是制备太阳能电池的主要原料
⑤SO2可用来漂白馒头、银耳等食品.
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ②③④ |
17.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4 g 金属镁变成镁离子时失去的电子数为 0.2 NA | |
| B. | 标准状况下,18 g H2O中含有NA个水分子 | |
| C. | 常温常压下,11.2 L H2和O2的混合物所含分子个数是 0.5 NA | |
| D. | 1 mol/L NaOH溶液中含有的Na+数目是NA |
17.设NA为阿伏加德罗常数,下列有关叙述正确的是( )
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为($\frac{7}{22.4}$)NA | |
| B. | 1mol羟基(-OH)所含的电子总数为10NA | |
| C. | 硝化甘油、火棉、TNT都是硝酸酯 | |
| D. | 1mol碳正离子(CH3+)所含的电子总数为8NA |
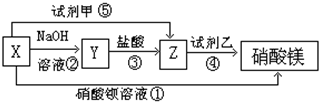
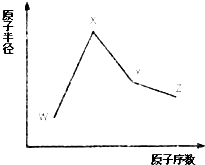 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小. ;
;