题目内容
2.下列元素相关粒子的电子排布式中,前者一定是金属元素,后者一定是非金属元素的是( )| A. | [Ne]3s1[Ne]3s2 | B. | [Ar]4s1[Ne]3s23p4 | ||
| C. | [Ne]3s2[Ar]4s2 | D. | [He]2s22p4[Ne]3s23p5 |
分析 A.[Ne]3s1为Na,[Ne]3s2为Mg;
B.[Ar]4s1为K,[Ne]3s23p4为S;
C.[Ne]3s2为Mg,[Ar]4s2为Ca;
D.[He]2s22p4为O,[Ne]3s23p5为Cl.
解答 解:A.[Ne]3s1为Na,[Ne]3s2为Mg,二者均为金属元素,故A不符合;
B.[Ar]4s1为K,[Ne]3s23p4为S,前者是金属元素,后者是非金属元素,故B符合;
C.[Ne]3s2为Mg,[Ar]4s2为Ca,二者均为金属元素,故C不符合;
D.[He]2s22p4为O,[Ne]3s23p5为Cl,二者均为非金属元素,故D不符合,
故选:B.
点评 本题考查核外电子排布、原子结构与元素性质等,比较基础,关键根据核外电子排布确定元素,有利于基础知识的巩固.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
12.下列说法正确的是( )
| A. | 室温时,在水电离出c(H+)=1.0×10-12mol•L-1的溶液中,K+、Na+、HCO3-、Cl-一定能大量共存 | |
| B. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 常温下,pH=2的醋酸溶液中所含有的H+数为0.01 NA | |
| D. | 将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体分子数大于NA |
13.常温下下列关系的表述中,正确的是( )
| A. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| B. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 | |
| C. | 0.1 mol•L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | 浓度均为0.1 mol/L的三种溶液:①Na2CO3溶液;②NaOH溶液;③CH3COONa溶液,溶液的pH:②>③>① |
17.下列分子中既含有极性键又含有非极性键且为极性分子的是( )
| A. | CS2 | B. | CH4 | C. | CH3CH2Cl | D. | CH≡CH |
7.元素R的最高价含氧酸分子式为HnRO2n-2,则在R的气态氢化物中,R元素的化合价为( )
| A. | 3n-12 | B. | 3n-6 | C. | 3n-4 | D. | 2n-4 |
11.下列物质存在顺反异构体的是( )
| A. | 2-氯丙烷 | B. | 氯乙烯 | C. | 2-丁烯 | D. | 1-丁烯 |
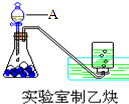 (1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑. ;
; .
.