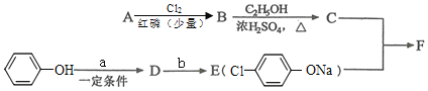
题目内容
【题目】MgO、Al2O3都是常用的耐火材料,某研究小组取100 kg含60%Al的报废汽车的镁合金材料来制备MgO、Al2O3,其中物质甲可由溶液B转化再生,其工艺流程如图所示。
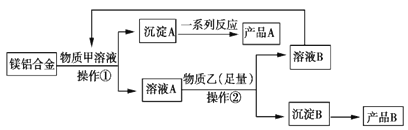
请回答下列问题:
(1)下列说法正确的是__________(填字母)。
A.合金是金属与金属熔合而成的混合物
B.合金的熔点比成分金属更高
C.合金的硬度等机械性能优于成分金属
D.氧化铝熔点高,故可以用氧化铝坩埚熔融氢氧化钠
(2)物质甲是________________,产品A是________________。
(3)操作②为____________。
(4)足量物质乙与溶液A发生反应的离子方程式为___________________________。
(5)假设不计损耗,可得产品B的质量为__________kg。(保留一位小数)
【答案】C NaOH MgO 过滤 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 113.3
【解析】
镁铝合金材料经过物质甲溶液后,得到沉淀和溶液,所以甲是氢氧化钠溶液,沉淀A是镁,溶液A是氢氧化钠和偏铝酸钠的混合溶液,所以产品A是氧化镁,物质乙是二氧化碳,过量二氧化碳与混合液反应生成碳酸氢钠溶液,则溶液B是碳酸氢钠溶液,沉淀B是氢氧化铝,所以产品B是氧化铝,据此分析即可。
(1)A.合金不一定是金属和金属的混合物,错误;
B.合金的熔点比成分金属的熔点低,错误;
C.合金的硬度等机械性能一般优于成分金属,正确;
D.氧化铝的熔点高,可作为坩埚,但氧化铝能与强碱反应,不能用于熔融氢氧化钠,错误;
(2)Al与NaOH溶液反应,而Mg不与NaOH溶液反应,将镁铝合金投入NaOH溶液中,完全反应后过滤得到固体Mg和NaAlO2溶液,沉淀A为Mg,Mg与酸反应得Mg2+,Mg2+与碱溶液反应生成Mg(OH)2,加热Mg(OH)2得产品A(MgO)。沉淀B为Al(OH)3,加热Al(OH)3得到产品B(Al2O3);
(3)操作②为固液不相溶分离,故该操作为过滤;
(4)向NaAlO2溶液中通入过量的CO2,得到Al(OH)3沉淀和NaHCO3,其反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)100 kg合金中含有60 kg Al,根据铝元素守恒,最终可得Al2O3的质量=(60kg×102g/mol)÷(2×27g/mol)≈113.3kg。