题目内容
19.写出下列各烃的名称(1)(CH3)2CH(CH2)2CH(C2H5)(CH2)2CH3
(2)
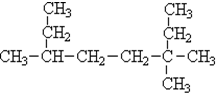
(3)

(4)
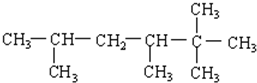
分析 (1)选最长碳链为主链,从离取代基较近的位置开始编号,定为某烷烃,再根据取代基的位置和名称书写名称;
(2)最长的碳链含有8个C,主链为辛烷,在3号碳上有2个甲基、6号C有1个甲基;
(3)该烃属于烯烃,从距碳碳双键最近的一端编号,碳碳双键在1号C,甲基在3号C,在2号C含有1个乙基;
(4)最长的碳链含有6个C,主链为己烷,在2号碳上有2个甲基、3和5号C有1个甲基,据此回答.
解答 解:(1))(CH3)2CH(CH2)2CH(C2H5)(CH2)2CH3,最长的碳链含有8个C,主链为辛烷,编号从左边开始,满足取代基编号之和最小,在2号碳上有1个甲基、5号C有1个乙基,该有机物命名为:2-甲基-5-乙基辛烷,
故答案为:2-甲基-5-乙基辛烷;
(2)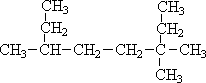 ,最长的碳链含有8个C,主链为辛烷,编号从右边开始,满足取代基编号之和最小,在3号碳上有2个甲基、6号C有1个甲基,该有机物命名为:3,3,6-三甲基辛烷,
,最长的碳链含有8个C,主链为辛烷,编号从右边开始,满足取代基编号之和最小,在3号碳上有2个甲基、6号C有1个甲基,该有机物命名为:3,3,6-三甲基辛烷,
故答案为:3,3,6-三甲基辛烷;
(3) 为烯烃,从距碳碳双键最近的一端编号,碳碳双键在1号C,甲基在3号C,在2号C含有1个乙基,该有机物名称为:3-甲基-2-乙基-1-丁烯,
为烯烃,从距碳碳双键最近的一端编号,碳碳双键在1号C,甲基在3号C,在2号C含有1个乙基,该有机物名称为:3-甲基-2-乙基-1-丁烯,
故答案为:3-甲基-2-乙基-1-丁烯;
(4)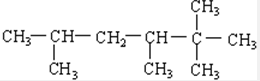 ,最长的碳链含有6个C,主链为己烷,编号从右边开始,满足取代基编号之和最小,在2号碳上有2个甲基、3和5号C有1个甲基,该有机物命名为:2,2,3,5-四甲基己烷,
,最长的碳链含有6个C,主链为己烷,编号从右边开始,满足取代基编号之和最小,在2号碳上有2个甲基、3和5号C有1个甲基,该有机物命名为:2,2,3,5-四甲基己烷,
故答案为:2,2,3,5-四甲基己烷.
点评 本题考查了有机物的命名,有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长--选最长碳链为主链;
②多--遇等长碳链时,支链最多为主链;
③近--离支链最近一端编号;
④小--支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简--两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.
(2)有机物的名称书写要规范;
(3)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小;
根据以上知识对有机物进行命名.

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | ${\;}_{94}^{214}$Pu位于周期表中第六周期 | |
| B. | ${\;}_{53}^{131}$ I与${\;}_{53}^{125}$I性质完全相同 | |
| C. | ${\;}_{53}^{131}$I与${\;}_{53}^{125}$I 互为同位素 | |
| D. | ${\;}_{53}^{131}$I的质子数为78 |
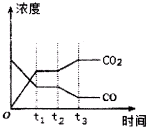 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0.
| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是降低温度或降低H2浓度或增大H2O(g)浓度.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+$\frac{1}{2}$O2(g)?CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“.
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
| A. | 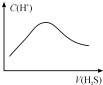 随着 H2S气体的通入,溶液中由水电离出的c(H+)有如图变化关系 | |
| B. | 当$\frac{V}{22.4}$=a b时,所得溶液中存在:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 当$\frac{V}{11.2}$=a b时,所得溶液中存在:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c( H+) | |
| D. | 当$\frac{V}{22.4}$<a b<$\frac{V}{11.2}$时,所得溶液中一定存在:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| A. | Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原 | |
| B. | CuI既是氧化产物又是还原产物 | |
| C. | 每生成1 mol CuI,有12 mol KI发生氧化反应 | |
| D. | 每转移1.1 mol电子,有0.2 mol $\stackrel{+5}{I}$被氧化 |
| A. | Hm+2bXOb | B. | Hm-2bXOb | C. | Hb+mXOb | D. | H2b-mXOb |
| A. | 常温下稀释溶液0.1mol•L-1CH3COONa溶液,$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$变大 | |
| B. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 25℃时,pH=3的硫酸溶液中水的电离程度大于pH=11的氨水溶液中水的电离程度 | |
| D. | 等浓度的NaCl和CH3COONa等体积混合,则混合溶液中:c(Na+)>c(Cl-)>c(OH-)>c(CH3COO-)>c(H+) |
| A. | 向外供电时,锂离子向负极移动 | |
| B. | 负极上反应的物质是锂,正极上反应的物质是V2O5 | |
| C. | 正极的电极反应为:V2O5+xe-+xLi+═LixV2O5 | |
| D. | 负极的电极反应为:xLi-xe-═xLi+ |
 (Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等.
(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等. .
.