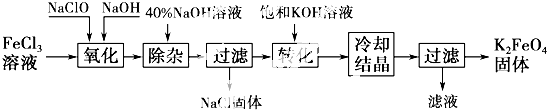
题目内容
9.氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业.为生成氮化硅膜,可以用NH3和SiH4(硅烷)在一定条件下反应并在600℃的加热基板上生成氮化硅膜:3SiH4$\frac{\underline{\;一定条件\;}}{\;}$Si3N4+12H2
(1)以硅化镁为原料制备硅烷的反应和工业流程如图1:
反应原理:4NH4Cl+Mg2Si$\frac{\underline{\;常温\;}}{\;}$4NH3↑+SiH4↑+2MgCl2(△H<0)

①NH4Cl的化学键类型有极性键(或共价键)、离子键,SiH4电子式为
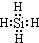 .
.②上述生产硅烷的过程中液氨的作用是吸收热量,保证反应在常温下进行(答“制冷”或“降温”均可).
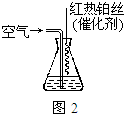
③氨气也是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,实验室可利用如图2所示装置完成该反应. 在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是NH4NO3(或硝酸铵).
 (2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.
(2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.将0.184g三硅酸镁加到50mL 0.1mol/L盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用0.1mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30mL,则Mg2Si3O8?nH2O的n值为6.(注:Mg2Si3O8的摩尔质量为260g/mol)
分析 根据题中流程可知,硅与镁在合成炉中生成Mg2Si,Mg2Si与氯化铵生成粗硅烷和氨气,经过冷凝器分离出液氨可循环使用,同时得到粗硅烷,
(1)①氯化铵中铵根离子和氯离子之间是离子键,铵根离子内部存在共价键,根据电子式的书写方法来回答;
②根据液氨的性质:易液化来回答;
③氨气的催化氧化产物是一氧化氮和水,一氧化氮遇到空气迅速变为二氧化氮,二氧化到可以和水反应得到硝酸,硝酸可以和氨气反应生成硝酸铵;
(2)三硅酸镁中和胃酸(HCl)生成氯化镁和硅酸,反应的化学方程式为:Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O,根据题意,被氢氧化钠中和的盐酸的物质的量为0.003mol,所以与三硅酸镁反应的盐酸为0.005mol-0.003mol=0.002mol,根据化学方程式,列比例式可计算出n的值.
解答 解:根据题中流程可知,硅与镁在合成炉中生成Mg2Si,Mg2Si与氯化铵生成粗硅烷和氨气,经过冷凝器分离出液氨可循环使用,同时得到粗硅烷,
(1)①氯化铵中铵根离子和氯离子之间是离子键,铵根离子内部存在共价键,极性键(或共价键)、离子键,硅甲烷中硅原子和氢原子之间以共价键结合,电子式为: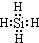 ,
,
故答案为:极性键(或共价键)、离子键;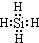 ;
;
②液氨的性质:易液化,上述生产硅烷的过程中液氨的作用是:吸收热量,保证反应在常温下进行,
故答案为:吸收热量,保证反应在常温下进行(答“制冷”或“降温”均可);
③氨气的催化氧化产物是一氧化氮和水,即4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,因为一氧化氮遇到空气迅速变为二氧化氮,二氧化氮可以和水反应得到硝酸,硝酸可以和氨气反应生成硝酸铵,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;NH4NO3(或硝酸铵);
(2)三硅酸镁中和胃酸(HCl)生成氯化镁和硅酸,反应的化学方程式为:Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O,根据题意,被氢氧化钠中和的盐酸的物质的量为0.003mol,所以与三硅酸镁反应的盐酸为0.005mol-0.003mol=0.002mol,根据化学方程式,设0.184gMgSi3O8•nH2O的物质的量是x,得
Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O
1 4
x 0.002mol
$\frac{1}{x}$=$\frac{4}{0.002mol}$,解得x=0.0005mol,所以MgSi3O8•nH2O的摩尔质量是$\frac{0.184}{0.0005}$g/mol=368g/mol,Mg2Si3O8的摩尔质量为260g/mol,所以18n=108,即n=6.
故答案为:Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O;6.
点评 本题考查学生复杂化学时的确立方面的知识,要求学生具有分析和解决问题的能力,难度大.

| A. | Al2(SO4)3═3Al3++2SO42- | B. | AlCl3═Al3++Cl3- | ||
| C. | Mg(NO3)2═Mg2++2NO3- | D. | KMnO4═K++Mn2++4O2- |
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g•cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

实验一:制取苯甲酸甲酯
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸加入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,试管中盛放的液体可能是Na2CO3稀溶液,烧瓶中反应的方程式为
 .
.实验二:提纯苯甲酸甲酯
(2)停止加热,待烧瓶内的混合物冷却后,将试管及烧瓶中的液体转移到分液漏斗中,然后塞上分液漏斗的塞子再振荡后静置,取下塞子、打开活塞,使(填主要成分的名称)苯甲酸甲酯进入锥形瓶,此时目标产物中所含杂质量最多的物质是甲醇.
(3)用图C装置进行蒸馏提纯时,当温度计显示199.6℃时,可用锥形瓶收集苯甲酸甲酯.
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(4)为确定浓硫酸对此反应存在催化作用,可另取等量反应物在不加浓硫酸情况下进行相同程度的加热,然后测量两个实验中的某种数据,该数据是相同时间内两个试管里生成有机层的厚度或两个试管中生成相同厚度的有机层所需的时间.
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 如果浓H2SO4沾到皮肤上,可立即用大量水冲洗,然后涂上硼酸溶液 | |
| D. | 如果少量酒精失火燃烧,可用湿抹布盖灭火焰 |
| A. | 工业上冶炼钠,是通过电解氯化钠饱和溶液 | |
| B. | 工业上冶炼铝,如果以石墨为电极,则阳极石墨需要不断补充 | |
| C. | 工业上冶炼镁,是电解熔融氧化镁 | |
| D. | 工业上精炼铜是粗铜为阴极 |
| A. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| B. | pH=1的溶液:Na+、K+、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$ | |
| C. | 含有大量Al3+的溶液:Na+、NH4+、SO${\;}_{4}^{2-}$、Cl- | |
| D. | 含有大量NO3-的溶液:H+、Fe2+、SO${\;}_{4}^{2-}$、Cl- |