题目内容
17.在一体积为2L的密闭容器中加入反应物A、B,发生如下反应:A+2B═3C.反应经2min后,A的浓度从开始时的1.0mol/L 降到0.8mol/L.已知反应开始时B的浓度是1.2mol/L.求:(1)2min末B的浓度?
(2)2min内,用A物质的浓度变化来表示该反应的反应速率,即v(A)
分析 (1)由方程式可知△c(B)=2△c(A),2min末B的浓度=B的起始浓度-△c(B);
(2)根据v=$\frac{△c}{△t}$计算v(A).
解答 解:(1)△c(A)=1.0mol/L-0.8mol/L=0.2mol/L,由A+2B═3C,可知△c(B)=2△c(A)=0.4mol/L,故2min末B的浓度=1.2mol/L-0.4mol/L=0.8mol/L,
答:2min末B的浓度为0.8mol/L.
(2)2min内△c(A)=0.2mol/L,则v(A)=$\frac{0.2mol/L}{2min}$=0.1mol/(L.min),
答:2min内用A物质的浓度变化来表示该反应的反应速率为0.1mol/(L.min).
点评 本题考查化学平衡计算、化学反应速率计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
16.已知:Fe(OH)3不溶于过量氨水,Cu(OH)2溶于过量氨水,转化为[Cu(NH3)4]2+.现有等物质的量组成的铁铜合金0.1mol,研成粉末后,全部投入稀硝酸中,微热使其充分反应,硝酸的还原产物只有NO.由于HNO3用量的不同,溶液中的金属离子和残留固体的成分会有多种情况.下列说法正确的是( )
| A. | 根据溶液中的金属离子和残留固体的成分最多会有6种情况 | |
| B. | 若金属有剩余,在溶液中再滴入稀硫酸后,金属不会再溶解 | |
| C. | 当合金刚好溶解时,在标准状况下产生2.24LNO | |
| D. | 若合金全部溶解,在溶液中加入过量的氨水,经过滤、洗涤、干燥、充分灼烧、称量得固体5.35g |
6.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,不一定能产生沉淀的是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCI | CO2 | 石灰水 |
| ③ | NO2 | SO2 | BaCI2 |
| ④ | CO2 | NH3 | CaCI2 |
| A. | ②④ | B. | ① | C. | ①③ | D. | ④ |
7.现有A、B、C三种化合物,各取40g相混合,完全反应后,得到18.0g B、49.0g C、还有D生成,已知D的相对分子质量为106.现将22.0g A和11.0g B反应,能生成D的物质的量为( )
| A. | 1.00mol | B. | 0.500mol | C. | 0.275mol | D. | 0.250mol |
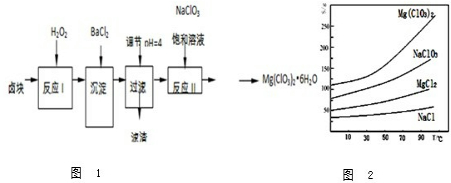


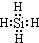 .
. (2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.
(2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.