题目内容
18.下列溶液中一定能大量共存的离子组是( )| A. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| B. | pH=1的溶液:Na+、K+、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$ | |
| C. | 含有大量Al3+的溶液:Na+、NH4+、SO${\;}_{4}^{2-}$、Cl- | |
| D. | 含有大量NO3-的溶液:H+、Fe2+、SO${\;}_{4}^{2-}$、Cl- |
分析 A.铁离子与硫氰根离子反应生成络合物硫氰化铁;
B.pH=1的溶液中存在大量氢离子,碳酸根离子与氢离子反应;
C.四种离子之间不反应,都不与铝离子反应;
D.硝酸根离子在酸性条件下能够氧化亚铁离子.
解答 解:A.Fe3+和SCN-之间反应生成硫氰化铁,在溶液中不能大量共存,故A错误;
B.pH=1的溶液为酸性溶液,溶液中存在大量氢离子,CO32-与氢离子反应,在溶液中不能大量共存,故B错误;
C.Na+、NH4+、SO42-、Cl-之间不反应,都不与Al3+反应,在溶液中能够大量共存,故C正确;
D.NO3-、H+、Fe2+之间发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查了离子共存的判断,题目难度中等,明确离子反应发生条件及题中暗含条件的含义为解答关键,注意熟练掌握判断离子共存的常用方法,D为易错点,注意硝酸根离子在酸性条件下具有强氧化性,试题有利于培养学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
6.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,不一定能产生沉淀的是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCI | CO2 | 石灰水 |
| ③ | NO2 | SO2 | BaCI2 |
| ④ | CO2 | NH3 | CaCI2 |
| A. | ②④ | B. | ① | C. | ①③ | D. | ④ |
13.可以验证硫元素的非金属性比氯元素弱的事实是( )
①H2S溶于水是弱酸,HC1溶于水是强酸②向氢硫酸溶液中通入氯气有单质硫生成
③还原性:S2->Cl- ④高氯酸(HCl04)的酸性比硫酸强.
①H2S溶于水是弱酸,HC1溶于水是强酸②向氢硫酸溶液中通入氯气有单质硫生成
③还原性:S2->Cl- ④高氯酸(HCl04)的酸性比硫酸强.
| A. | ①②④ | B. | ②④ | C. | ②③④ | D. | ①②③④ |
3.下列电离方程式正确的是( )
| A. | 醋酸溶于水:CH3COOH=CH3COO-+H+ | |
| B. | 熔融状态下的NaHSO4:NaHSO4=Na++H++SO42- | |
| C. | 碳酸氢钠溶于水:NaHCO3=HCO3-+Na+ | |
| D. | 硫化氢溶于水:H2S?2H++S2- |
10.2015年9月24日双鸭山市区发生严重的雾霾天气,对人们的健康造成严重威胁,环境问题离我们也并不遥远了,则下列有关环境问题说法正确的是( )
| A. | PH<7的雨水称为酸雨 | |
| B. | 二氧化硫的大量排放是造成光化学烟雾的主要原因 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌等疾病的发生相关 | |
| D. | SO2、CO2、NO2均属于大气污染物 |
7.现有A、B、C三种化合物,各取40g相混合,完全反应后,得到18.0g B、49.0g C、还有D生成,已知D的相对分子质量为106.现将22.0g A和11.0g B反应,能生成D的物质的量为( )
| A. | 1.00mol | B. | 0.500mol | C. | 0.275mol | D. | 0.250mol |
8.从下列事实所列出的相应结论正确的是( )
| 实验事实 | 结论 | |
| ① | 铜生的锈是绿色的称为铜绿 | 铜绿是致密的氧化膜 |
| ② | 浓硫酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液 | 都发生了氧化还原反应 |
| ③ | 少量CO2通入Na[Al(OH)4]溶液产生白色沉淀和Na2CO3 | 酸性:HCO3->Al(OH)3 |
| ④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀现象 | 确定该溶液存在CO${\;}_{3}^{2-}$ |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH${\;}_{4}^{-}$ |
| A. | ②③⑤ | B. | ①②③ | C. | ③④⑤ | D. | 全部 |
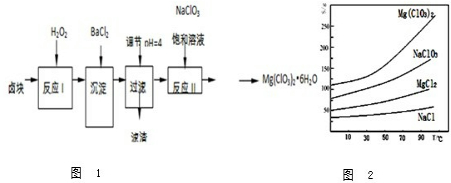

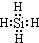 .
. (2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.
(2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.