题目内容
2.C、N、O、Na、S、Cl是常见的六种短周期元素(1)S位于元素周期表第三周期第ⅥA族,Na的基态原子核外电子排布式为1s22s22p63s1.
(2)用“>”或“<”填空
| 未成对电子数 | 电负性 | 气态氢化物稳定性 | 酸性 |
| N>O | C<N | H2S<H2O | H2SO4<HClO4 |
(4)加热条件下,Cl2通过浓NaOH溶液中生成两种钠盐(物质的量之比为1:5),写出反应的化学方程式并标出电子转移的方向的数目:
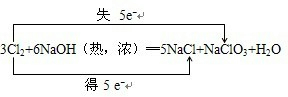 .
.
分析 (1)根据电子层数=周期序数,主族序数=最外层电子数;Na是11号元素,其原子核外有11个电子,根据构造原理书写其基态原子核外电子排布式;
(2)根据构造原理书写各原子的电子排布式,根据电子排布式判断未成对电子数即可;
同一周期,从左到右,元素的电负性逐渐增大;
元素的非金属性越强,对应的氢化物的稳定性越强;
元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
(3)1个单键有1个σ键,叁键中有2个π键和1个σ键;氮原子非金属性强,氨分子之间容易形成氢键,使其沸点升高而容易液化;
(4)先根据化合价升高和降低的元素均是氯元素,两种钠盐的物质的量之比为1:5,则化合价由0价分别变化为+5价、-1价,根据化合价降低元素所在的反应物是氧化剂,化合价升高元素所在的反应物是还原剂,反应中,化合价升高数目=化合价降低数目=转移电子数目.
解答 解:(1)S元素的原子核外有3个电子层,最外层电子数为6,所以位于元素周期表第三周期第ⅥA族;Na是11号元素,其原子核外有11个电子,核外电子基态排布式为1s22s22p63s1;
故答案为:三;ⅥA;1s22s22p63s1;
(2)N的电子排布式为1s22s22p3,未成对电子数为3;O的电子排布式为1s22s22p4,未成对电子数为2,所以未成对电子数N>O;
同一周期,从左到右,元素的电负性逐渐增大,所以电负性:C<N;
同主族元素从上到下非金属性逐渐减弱,非金属性:O>S,元素的非金属性越强,对应的氢化物的稳定性越强,所以气态氢化物稳定性:H2S<H2O;
同周期元素从左到右元素的非金属性逐渐增强,非金属性:Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,酸性:H2SO4<HClO4;
故答案为:>;<;<;<;
(3)(CN)2分子中所有原子均达到8电子稳定结构,结构式为:N≡C-C≡N,1个单键有1个σ键,叁键中有2个π键和1个σ键,α键与π键分别为3,4,个数之比为3:4;氮原子非金属性强,氨分子之间容易形成氢键,氢键的存在使得氨气分子间作用力显著增强,沸点显著升高,易液化;
故答案为:3:4;NH3分子间可形成氢键,沸点显著升高,易液化;
(4)化合价升高和降低的元素均是氯元素,两种钠盐的物质的量之比为1:5,则化合价由0价分别变化为+5价、-1价,即产物为NaClO3、NaClO,化合价升高数目=化合价降低数目=转移电子数目=5,电子转移的方向和数目如下所示: ;
;
故答案为: .
.
点评 本题主要考查了核外电子排布、元素性质的比较、化学键以及氧化还原反应,难度不大,注意对应知识的运用.

| A. | 2s22p2和2s22p4 | B. | 3s23p4和2s22p4 | C. | 3s2和2s22p5 | D. | 3s1和3s23p4 |
| A. | C10H16 | B. | C11H14 | C. | C12H18 | D. | C13H20 |
| 选项 | 反应物质 | 反应结果 | 影响因素 |
| A | Na O2 | Na2O Na2O2 | 反应温度 |
| B | Cu HNO3 | NO NO2 | 铜的还原性 |
| C | 澄清石灰水 CO2 | 浑浊或者澄清 | CO2通入量 |
| D | Na2CO3溶液 盐酸 | 立即产生气体或最后产生气体 | 试剂加入顺序 |
| A. | A | B. | B | C. | C | D. | D |
| A. | N4的摩尔质量是56 g | |
| B. | N4与N2互为同位素 | |
| C. | 相同质量的N4和N2含原子个数比为1:2 | |
| D. | N4与N2互为同素异形体 |
| A. | n+11 | B. | n+1 | C. | n+3 | D. | n+4 |
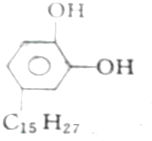
①漆酚
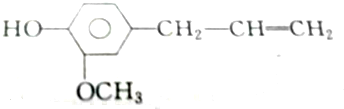
②丁香油酚
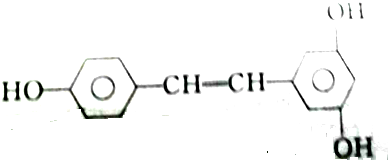
③白藜芦醇
| A. | 2mol、2mol、6mol | B. | 5mol、2mol、6mol | C. | 4mol、2mol、5mol | D. | 3mol、2mol、6mol |
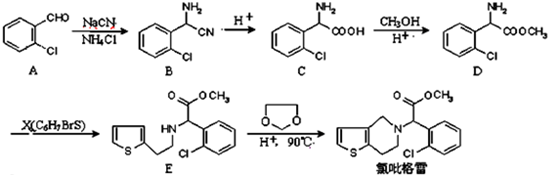
 .
. .
.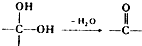 ②
②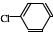 中氯原子较难水解物质A(
中氯原子较难水解物质A(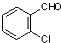 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式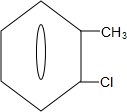 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$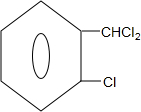 +2HCl;
+2HCl;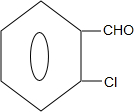 +2NaCl+2H2O
+2NaCl+2H2O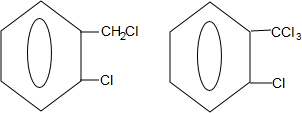
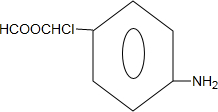
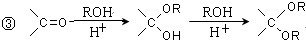
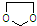 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$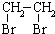
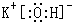 (填写电子式);
(填写电子式);