题目内容
7.据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )| A. | N4的摩尔质量是56 g | |
| B. | N4与N2互为同位素 | |
| C. | 相同质量的N4和N2含原子个数比为1:2 | |
| D. | N4与N2互为同素异形体 |
分析 A.N4的摩尔质量是56 g/mol;
B.N4与N2是氮元素组成的不同单质;
C.N4和N2均由N原子构成,二者质量相等,含有N原子数目相等;
D.N4与N2是氮元素组成的不同单质.
解答 解:A.1molN4的质量为56g,而N4的摩尔质量是56 g/mol,故A错误;
B.同位素研究对象为原子,N4与N2是氮元素组成的不同单质,二者互为同素异形体,故B错误;
C.N4和N2均由N原子构成,二者质量相等,含有N原子数目相等,相同质量的N4和N2含原子个数比为1:1,故C错误;
D.N4与N2是氮元素组成的不同单质,二者互为同素异形体,故D正确,
故选D.
点评 本题考查摩尔质量、同位素、同素异形体、物质的量有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
17.按所示格式填写下表有序号的表格:
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 17 | ①1s2 2s22p6 3s23p5 | ②3s23p5 | ③3 | ④ⅤⅡA |
| ⑤10 | 1s22s22p6 | ⑥2s22p6 | ⑦2 | ⑧0 |
| ⑨24 | ⑩1s2 2s22p6 3s23p63d5 4s1 | 3d54s1 | (11) | ⅥB |
18.某化学学习小组讨论辨析以下说法,其中正确的是( )
①福尔马林、聚苯乙烯、油脂、生铁、铝热剂、肥皂均是混合物
②冰和干冰都是酸性氧化物,固体时是分子晶体
③小苏打、硬脂酸钠、BaSO4、Al2O3都是强电解质
④CO2,NH3,SO2,H2S,Cl2都是非电解质
⑤鸡蛋清溶液,淀粉溶液,空气,雾都是胶体
⑥苯酚,纯碱,胆矾和H2O2分别属于酸、碱、盐和氧化物.
①福尔马林、聚苯乙烯、油脂、生铁、铝热剂、肥皂均是混合物
②冰和干冰都是酸性氧化物,固体时是分子晶体
③小苏打、硬脂酸钠、BaSO4、Al2O3都是强电解质
④CO2,NH3,SO2,H2S,Cl2都是非电解质
⑤鸡蛋清溶液,淀粉溶液,空气,雾都是胶体
⑥苯酚,纯碱,胆矾和H2O2分别属于酸、碱、盐和氧化物.
| A. | ①③⑤ | B. | ①②④⑤ | C. | ①②③⑤ | D. | ①②③④⑤⑥ |
2.C、N、O、Na、S、Cl是常见的六种短周期元素
(1)S位于元素周期表第三周期第ⅥA族,Na的基态原子核外电子排布式为1s22s22p63s1.
(2)用“>”或“<”填空
(3)(CN)2分子中所有原子均达到8电子稳定结构,该分子中α键与π键之比为3:4,氨气可作低温溶剂,它易液化的原因是NH3分子间可形成氢键,沸点显著升高,易液化.
(4)加热条件下,Cl2通过浓NaOH溶液中生成两种钠盐(物质的量之比为1:5),写出反应的化学方程式并标出电子转移的方向的数目: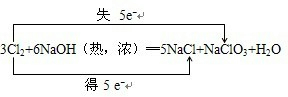 .
.
(1)S位于元素周期表第三周期第ⅥA族,Na的基态原子核外电子排布式为1s22s22p63s1.
(2)用“>”或“<”填空
| 未成对电子数 | 电负性 | 气态氢化物稳定性 | 酸性 |
| N>O | C<N | H2S<H2O | H2SO4<HClO4 |
(4)加热条件下,Cl2通过浓NaOH溶液中生成两种钠盐(物质的量之比为1:5),写出反应的化学方程式并标出电子转移的方向的数目:
 .
.
19.关于元素周期表和元素周期律的应用有如下叙述:其中正确的是( )
①元素周期表是同学们学习化学知识的一种重要工具;
②利用元素周期表可以预测新元素的原子结构和性质;
③利用元素周期表和元素周期律可以预言新元素;
④利用元素周期表可以指导寻找某些特殊的材料.
①元素周期表是同学们学习化学知识的一种重要工具;
②利用元素周期表可以预测新元素的原子结构和性质;
③利用元素周期表和元素周期律可以预言新元素;
④利用元素周期表可以指导寻找某些特殊的材料.
| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ②③ |
14.有一化学反应:aA+bB?C,根据影响化学反应速率的因素可得v0=kcm(A)cn(B),其中k是与温度有关的常数,为测得k、m、n的值,在298K时,将A、B溶液按不同浓度混合,得到下表中的实验数据:
(1)依表中数据可求得m=1,n=2,k=1.2×10-2,k的单位是L2•mol-2•s-1.
(2)若a=m,b=n,当c(A)=c(B)=2.0mol•L-1时,求以B表示的初始反应速率.
| 编号 | A的初$\frac{始浓度}{mol•{L}^{-1}}$ | B的初$\frac{始浓度}{mol•{L}^{-1}}$ | 生成C的$\frac{初始速率}{mol•{L}^{-1}•{s}^{-1}}$ |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 4.0 | 1.0 | 4.9×10-2 |
| 4 | 1.0 | 1.0 | 1.2×10-2 |
| 5 | 1.0 | 2.0 | 4.8×10-2 |
| 6 | 1.0 | 4.0 | 1.9×10-1 |
(2)若a=m,b=n,当c(A)=c(B)=2.0mol•L-1时,求以B表示的初始反应速率.
 焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂.某研究小组对焦亚硫酸钠进行如下研究:
焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂.某研究小组对焦亚硫酸钠进行如下研究:
 碳和水蒸汽的反应是吸热反应,如图所示是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量(E),试回答下列问题:
碳和水蒸汽的反应是吸热反应,如图所示是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量(E),试回答下列问题: