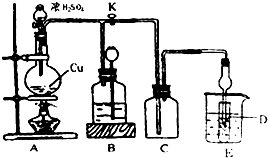
题目内容
9.已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A原子的价电子层的p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素.回答下列问题:(1)写出下列元素的符号:AB、BAl、CP;
(2)上述五种元素中最高价氧化物对应水化物酸性最强的是HClO4,(填写化学式)碱性最强的是
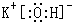 (填写电子式);
(填写电子式);(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是Cl,电负性最大的元素是Cl;
(4)在AD3分子中A元素原子的原子轨道发生的是sp2杂化,分子空间构型为平面三角形;
(5)将B 的单质投入E的最高价氧化物对应水化物中,发生反应的离子方程式是2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑.
分析 A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大,B、C、D元素的基态原子具有相同的能层数,处于同一周期,B、D元素的原子的p能级上都有1个未成对电子,价层电子排布为ns2np1或ns2np5,D原子得一个电子填入3p轨道后,3p轨道已充满,故D为Cl元素,B为Al元素,C原子的p轨道中有3个未成对电子,价层电子排布为3s23p3,故C为P元素;E是同周期第一电离能最小的元素,处于第ⅠA族,原子序数最大,故E处于第四周期,为K元素,A原子的价电子层的p轨道中只有1个电子,价层电子排布为ns2np1,处于第ⅢA族,原子序数最小,故A为B元素.
解答 解:A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大,B、C、D元素的基态原子具有相同的能层数,处于同一周期,B、D元素的原子的p能级上都有1个未成对电子,价层电子排布为ns2np1或ns2np5,D原子得一个电子填入3p轨道后,3p轨道已充满,故D为Cl元素,B为Al元素,C原子的p轨道中有3个未成对电子,价层电子排布为3s23p3,故C为P元素;E是同周期第一电离能最小的元素,处于第ⅠA族,原子序数最大,故E处于第四周期,为K元素,A原子的价电子层的p轨道中只有1个电子,价层电子排布为ns2np1,处于第ⅢA族,原子序数最小,故A为B元素,则
(1)由上述分析可知,A为B元素,B为Al元素,C为P元素,
故答案为:B、Al、P;
(2)五种元素中Cl元素非金属性最强,最高价氧化物对应水化物酸性最强的是HClO4,K元素的金属性最强,故KOH碱性最强,电子式为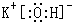 ,
,
故答案为:HClO4,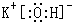 ;
;
(3)同周期自左而右,第一电离能增大,电负性增大,故第三周期中第一电离能最大的元素是Cl,电负性最大的元素是Cl,
故答案为:Cl;Cl;
(4)在BCl3分子中B原子成3个σ键,没有孤对电子,杂化轨道数目为3,采取sp2杂化,分子空间构型为平面三角形,
故答案为:sp2;平面三角形;
(5)Al与KOH反应的离子方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,
故答案为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑.
点评 考查元素推断、常用化学用语书写、元素周期律、杂化轨道与物质结构等,难度中等,注重物质结构的基础知识的考查.

(1)S位于元素周期表第三周期第ⅥA族,Na的基态原子核外电子排布式为1s22s22p63s1.
(2)用“>”或“<”填空
| 未成对电子数 | 电负性 | 气态氢化物稳定性 | 酸性 |
| N>O | C<N | H2S<H2O | H2SO4<HClO4 |
(4)加热条件下,Cl2通过浓NaOH溶液中生成两种钠盐(物质的量之比为1:5),写出反应的化学方程式并标出电子转移的方向的数目:
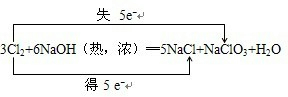 .
. ①蒸馏 ②过滤 ③分液 ④加入足量的钠⑤通入过量的C02⑥加入足量的NaOH溶液⑦加人足 FeCl3溶液⑧加入乙醇和浓硫酸的混合液⑨加人足 量的浓溴水⑩加人适量的盐酸.
| A. | ④⑤⑩ | B. | ⑥①⑤③ | C. | ⑨②⑧① | D. | ⑦①③⑩ |
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
| 编号 | A的初$\frac{始浓度}{mol•{L}^{-1}}$ | B的初$\frac{始浓度}{mol•{L}^{-1}}$ | 生成C的$\frac{初始速率}{mol•{L}^{-1}•{s}^{-1}}$ |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 4.0 | 1.0 | 4.9×10-2 |
| 4 | 1.0 | 1.0 | 1.2×10-2 |
| 5 | 1.0 | 2.0 | 4.8×10-2 |
| 6 | 1.0 | 4.0 | 1.9×10-1 |
(2)若a=m,b=n,当c(A)=c(B)=2.0mol•L-1时,求以B表示的初始反应速率.
| A. | Zn为正极 | B. | 负极反应式:O2+4H++4e-→2H2O | ||
| C. | 正极发生氧化反应 | D. | 电解液肯定不是强酸 |
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
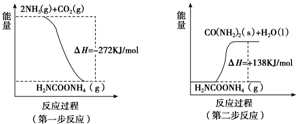
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式:
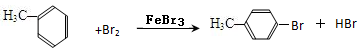 或
或
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
| A. | 制化肥 | B. | 制漂白粉 | ||
| C. | 酸洗 | D. | 医药、制炸药、农药 |