题目内容
11.根据元素周期表短周期元素的性质和递变规律,回答下列问题.(1)属于金属元素的有5种,金属性最强的元素与氧反应生成的化合物有Na2O、Na2O2(填两种化合物的化学式);
(2)属于稀有气体的是He、Ne、Ar(填元素符号,下同);
(3)形成化合物种类最多的元素是C、H;
(4)原子半径最大的是(稀有气体除外)Na;
(5)推测Si、N最简单氢化物的稳定性:NH3>SiH4(填化学式).
分析 (1)元素周期表中的1~18号元素来寻找金属元素的种数,短周期中金属性最强的为Na;
(2)元素周期表中的1~18号元素中0族元素为稀有气体;
(3)化合物种类最多的是含碳的有机物;
(4)电子层越多,半径越大;同一周期元素中,从左到右半径越来越小;
(5)同一周期元素中,从左到右元素非金属性越强,气态氢化物稳定性增强
解答 解:(1)1~8号元素有Li、Na、Al、Be和Mg共5种金属元素,金属性最强的为Na,Na和O2可以生成Na2O、Na2O2等,故答案为:5;Na2O;Na2O2;
(2)元素周期表1~18号元素中属于稀有气体的是He、Ne、Ar三种,故答案为:He、Ne、Ar;
(3)自然界中有机物种类繁多,形成化合物种类最多的两种元素是碳和氢,故答案为:C和H;
(4)电子层越多,半径越大,同一周期元素中,从左到右半径越来越小,因此短周期中半径最大的元素是Na,故答案为:Na;
(5)由于N的非金属性比Si强,所以氢化物的稳定性是NH3比SiH4稳定,故答案为:NH3;SiH4.
点评 本题考查元素性质的变化规律,为高频考点,把握元素的性质及元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
2.已知阴离子R2-的原子核内有x个中子,R原子的质量数为m,则WgR原子完全转化为R2-时,含有电子的物质的量是( )
| A. | $\frac{m-x-2}{W-m}$ mol | B. | $\frac{W(m-x)}{m}$ mol | C. | $\frac{W(m-x-2)}{m}$mol | D. | $\frac{W(m-x+2)}{m}$ mol |
6.某元素的原子核外有三个电子层,最外层有b个电子,下列对该元素的叙述正确的是( )
| A. | 该元素原子核内质子数为8+b | |
| B. | b≥4时形成的单质均为绝缘体 | |
| C. | 随着b数字的增大(b<8),元素的原子半径逐渐减小 | |
| D. | 随着b数字的增大,元素单质的还原性增强 |
3.分类是学习和研究化学的一种重要方法,下列分类不合理的是( )
| A. | K2CO3和CaSO4都属于盐 | B. | H2SO4和HNO3都属于酸 | ||
| C. | KOH和Fe(OH)3都属于碱 | D. | Na2O和Na2SiO3都属于氧化物 |
20.不能用磨口玻璃塞的试剂瓶盛装的溶液是( )
| A. | NaOH溶液 | B. | CuSO4溶液 | C. | AgNO3溶液 | D. | Na2SiO3溶液 |
1.0.1 mol•L-1的CH3COONH4溶液显中性,下列关于该溶液的说法正确的是 ( )
| A. | 该溶液中:c(CH3COO-)=c(NH4+)=0.1 mol•L-1 | |
| B. | 该溶液中:c(CH3C00H)=c(NH3•H20)=c(H+)=c(OH- ) | |
| C. | 该溶液中:c(CH3COOH)-c(OH-)=c(NH3.H20)-c(H+) | |
| D. | 该溶液中:c(CH3COO-)+c(CH3C00H)=c(NH3.H20)+c(NH4+)=0.4mol•L-1 |
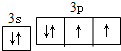 .
.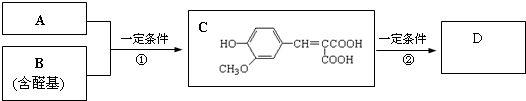
 .
.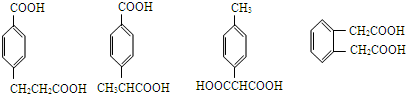 任意一种.
任意一种. ②
② ③
③ ④
④ ⑤
⑤ .请按要求填空:
.请按要求填空: .
.