题目内容
9.与铜同周期、基态原子最外层电子数与铜相同的过度元素,该元素基态原子未成对电子数有6个.分析 与铜同周期、基态原子最外层电子数相同的过渡元素,为24号元素Cr,其基态原子的电子排布式为[Ar]3d54s1,然后判断.
解答 解:与铜同周期、基态原子最外层电子数相同的过渡元素,为24号元素Cr,其基态原子的电子排布式为[Ar]3d54s1,3d轨道有5个单电子,4s轨道有1个单电子,所以素基态原子未成对电子数有6个.
故答案为:6.
点评 本题考查了基态原子的核外电子排布式,根据核外电子排布规律来解答,难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
20.不能用磨口玻璃塞的试剂瓶盛装的溶液是( )
| A. | NaOH溶液 | B. | CuSO4溶液 | C. | AgNO3溶液 | D. | Na2SiO3溶液 |
17.如表为元素周期表的一部分.
(1)表中元素F的非金属性最强;元素K的金属性最强;元素Br的单质在室温下呈液态;(写元素符号).
(2)表中半径最大的元素是K;(写元素符号)
(3)表中元素⑤、⑥、⑦对应的单质氧化性最强的是F2;(写化学式,下同)
(4)表中元素⑥、⑦氢化物的稳定性顺序为HCl>HBr;
(5)表中元素最高价氧化物对应水化物酸性最强的酸是HClO4.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ⑤ | |||||
| 三 | ③ | ⑥ | |||||
| 四 | ④ | ⑦ | |||||
(2)表中半径最大的元素是K;(写元素符号)
(3)表中元素⑤、⑥、⑦对应的单质氧化性最强的是F2;(写化学式,下同)
(4)表中元素⑥、⑦氢化物的稳定性顺序为HCl>HBr;
(5)表中元素最高价氧化物对应水化物酸性最强的酸是HClO4.
1.0.1 mol•L-1的CH3COONH4溶液显中性,下列关于该溶液的说法正确的是 ( )
| A. | 该溶液中:c(CH3COO-)=c(NH4+)=0.1 mol•L-1 | |
| B. | 该溶液中:c(CH3C00H)=c(NH3•H20)=c(H+)=c(OH- ) | |
| C. | 该溶液中:c(CH3COOH)-c(OH-)=c(NH3.H20)-c(H+) | |
| D. | 该溶液中:c(CH3COO-)+c(CH3C00H)=c(NH3.H20)+c(NH4+)=0.4mol•L-1 |
18. 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 充电时,电极A接电源的正极 | |
| B. | 充电时,电极B的反应式为Sx2--2e-═xS | |
| C. | 放电时,电极B为负极,Na+由A向B移动 | |
| D. | 放电时,负极反应式为2Na-2e-═2Na+ |
4.下列关于化学的叙述中,错误的是( )
| A. | 在化工生产中应遵循“绿色化学”的思想 | |
| B. | 通常用来衡量一个国家的石油化学工业发展水平的标志是乙烯的产量 | |
| C. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| D. | 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 |
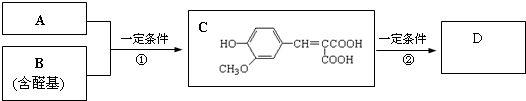
 .
.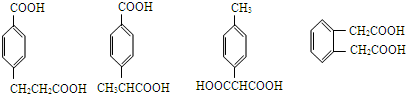 任意一种.
任意一种.
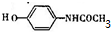 .
.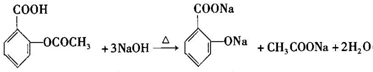 .
.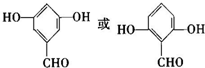 .
.