题目内容
6.下列表达方式错误的是( )| A. | 氯化氢分子的电子式: | B. | 硫化氢分子的S2-的结构示意图是: | ||
| C. | O-18原子的符号:818O | D. | CO2分子的结构式:O=C=O |
分析 A.氯化氢为共价化合物,分子中不存在阴阳离子;
B、硫离子的核电荷数为16,核外电子总数为18,最外层达到8电子稳定结构;
C、氧元素的质子数为8,O-18原子的质量数为18,元素符号的左上角为质量数、左下角为质子数;
D、CO2分子中存在两个碳氧双键,为直线型结构.
解答 解:A.氯化氢为共价化合物,分子中存在1个氢氯键,其正确的电子式为: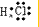 ,故A错误;
,故A错误;
B、硫离子的核电荷数为16,核外电子总数为18,其离子结构示意图为: ,故B正确;
,故B正确;
C、氧元素的质子数为8,O-18原子的质量数为18,该核素可以表示为:818O,故C正确;
D、CO2分子为直线型结构,分子中存在两个碳氧双键,二氧化碳的结构式为:O=C=O,故D正确;
故选A.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,注意掌握电子式、离子结构示意图、元素符号、结构式等化学用语的概念及书写原则,试题侧重考查学生规范答题的能力.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
17.如表为元素周期表的一部分.
(1)表中元素F的非金属性最强;元素K的金属性最强;元素Br的单质在室温下呈液态;(写元素符号).
(2)表中半径最大的元素是K;(写元素符号)
(3)表中元素⑤、⑥、⑦对应的单质氧化性最强的是F2;(写化学式,下同)
(4)表中元素⑥、⑦氢化物的稳定性顺序为HCl>HBr;
(5)表中元素最高价氧化物对应水化物酸性最强的酸是HClO4.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ⑤ | |||||
| 三 | ③ | ⑥ | |||||
| 四 | ④ | ⑦ | |||||
(2)表中半径最大的元素是K;(写元素符号)
(3)表中元素⑤、⑥、⑦对应的单质氧化性最强的是F2;(写化学式,下同)
(4)表中元素⑥、⑦氢化物的稳定性顺序为HCl>HBr;
(5)表中元素最高价氧化物对应水化物酸性最强的酸是HClO4.
1.0.1 mol•L-1的CH3COONH4溶液显中性,下列关于该溶液的说法正确的是 ( )
| A. | 该溶液中:c(CH3COO-)=c(NH4+)=0.1 mol•L-1 | |
| B. | 该溶液中:c(CH3C00H)=c(NH3•H20)=c(H+)=c(OH- ) | |
| C. | 该溶液中:c(CH3COOH)-c(OH-)=c(NH3.H20)-c(H+) | |
| D. | 该溶液中:c(CH3COO-)+c(CH3C00H)=c(NH3.H20)+c(NH4+)=0.4mol•L-1 |
11.下列说法正确的是( )
| A. | SO2与Na2SO3或NaHCO3溶液能发生反应 | |
| B. | SO2和CO2分别通入BaCl2和Ba(NO3)2溶液中都不产生沉淀 | |
| C. | 浓硫酸具有吸水性,因而能使蔗糖碳化 | |
| D. | SO2和O2混合加热,可生成三氧化硫 |
18. 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 充电时,电极A接电源的正极 | |
| B. | 充电时,电极B的反应式为Sx2--2e-═xS | |
| C. | 放电时,电极B为负极,Na+由A向B移动 | |
| D. | 放电时,负极反应式为2Na-2e-═2Na+ |
 ②
② ③
③ ④
④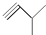 ⑤
⑤ .请按要求填空:
.请按要求填空: .
.
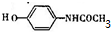 .
.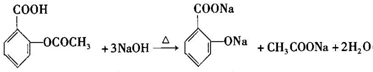 .
.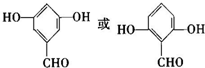 .
.
 .
.