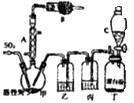
��Ŀ����
����Ŀ����̼�������Ե��ܺġ�����Ⱦ�����ŷ�Ϊ�����ľ���ģʽ����̼���õĸ������й���Ѹ�ٴӸ߶˸����ݱ��ȫ������Ϊ��������Դ��������ҵ���ܵȶ����������Ϊ�������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯���������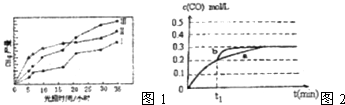
��1��ʵ�����ﳣ��NaOH��Һ����CO2 �� ����100mL 3molL��1��NaOH��Һ����4.48L����״���£�CO2 �� ��ȫ���շ�Ӧ��������Һ������Ũ���ɴ�С��˳��Ϊ
��2����ҵ�Ͽ�����CO��CO2���Ʊ����Һ��ȼ�ϼ״�����֪��800��ʱ����ѧ��Ӧ�١���Ӧ�ڶ�Ӧ��ƽ�ⳣ���ֱ�Ϊ2.5��1.0��Ӧ�٣�2H2��g��+CO��g��CH3OH��g����H=��90.8kJmol��1
��Ӧ�ڣ�H2��g��+CO2��g��H2O��g��+CO��g����H=+41.2kJmol��1
д����CO2��H2��Ӧ�Ʊ��״����Ȼ�ѧ����ʽ �� 800��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��K����ֵΪ
��3�����ù��ܺ�������ɽ�CO2��H2O��g��ת��ΪCH4��O2 �� ����������ʱ���ڲ�ͬ�������������£�CH4���������ʱ��ı仯��ͼ1��ʾ����0��15h�ڣ��Է�Ӧ��Ч����õĴ�����������ţ�
��4��һ���¶��£���3L�ݻ��ɱ���ܱ������з���������Ӧ�ڣ���֪c��CO���淴Ӧʱ��t�ı仯����a��ͼ2��ʾ����t1ʱ�̸ı�һ������������a��Ϊb����ı�������� �� ����t1ʱ�̣����������3L����ѹ����2L����ͼ�ϻ����仯����
��5�������仯�����ڹ�ҵ�����Ź㷺��Ӧ�ã��ڵؿ��г��������ε���ʽ���ڣ�BaSO4���������Σ���ҵ����ȡ��ʱ������Na2CO3��Һ��BaSO4ת�������������Σ�BaCO3������д����BaSO4ת����BaCO3�����ӷ���ʽ�÷�Ӧ��ƽ�ⳣ��Ϊ����������֣�����֪Ksp��BaSO4��=1.1��10��10mol2L��2 �� Ksp��BaCO3��=2.5��10��9mol2L��2
���𰸡�
��1��c��Na+����c��HCO3������c��CO32������c��OH������c��H+��
��2��CO2��g��+3H2��g��?CH3OH��g��+H2O��l����H=��49.6kJ/mol��2.5
��3����
��4�����������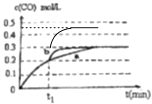
��5��BaSO4��s��+CO32����aq��=BaCO3��s��+SO42����aq����0.044
���������⣺��1��CO2���ʵ���Ϊ ![]() =0.2mol��NaOH���ʵ���Ϊ0.1L��3mol/L=0.3mol������1��n��NaOH����n��CO2��=3��2��2��������Ӧ��2CO2+3NaOH=Na2CO3+NaHCO3+H2O��Na2CO3��NaHCO3�����ʵ�����ȣ�̼������Ӻ�̼���������ˮ���ʹ��Һ�ʼ��ԣ���c��OH������c��H+����̼�������ˮ������̼��������ӣ�����c��HCO3������c��CO32����������ˮ��̶Ƚ�С������c��CO32������c��OH����������Һ�и�����Ũ�ȴ�С˳����c��Na+����c��HCO3������c��CO32������c��OH������c��H+���� ���Դ��ǣ�c��Na+����c��HCO3������c��CO32������c��OH������c��H+������2����Ӧ�٣�2H2��g��+CO��g��CH3OH��g����H=��90.8kJmol��1,��Ӧ�ڣ�H2��g��+CO2��g��H2O��g��+CO��g����H=+41.2kJmol��1,���ݸ�˹���ɣ���+�ڿɵã�CO2��g��+3H2��g��CH3OH��g��+H2O��l����H=��49.6kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=
=0.2mol��NaOH���ʵ���Ϊ0.1L��3mol/L=0.3mol������1��n��NaOH����n��CO2��=3��2��2��������Ӧ��2CO2+3NaOH=Na2CO3+NaHCO3+H2O��Na2CO3��NaHCO3�����ʵ�����ȣ�̼������Ӻ�̼���������ˮ���ʹ��Һ�ʼ��ԣ���c��OH������c��H+����̼�������ˮ������̼��������ӣ�����c��HCO3������c��CO32����������ˮ��̶Ƚ�С������c��CO32������c��OH����������Һ�и�����Ũ�ȴ�С˳����c��Na+����c��HCO3������c��CO32������c��OH������c��H+���� ���Դ��ǣ�c��Na+����c��HCO3������c��CO32������c��OH������c��H+������2����Ӧ�٣�2H2��g��+CO��g��CH3OH��g����H=��90.8kJmol��1,��Ӧ�ڣ�H2��g��+CO2��g��H2O��g��+CO��g����H=+41.2kJmol��1,���ݸ�˹���ɣ���+�ڿɵã�CO2��g��+3H2��g��CH3OH��g��+H2O��l����H=��49.6kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ��K= ![]() =
= ![]() ��
�� ![]() =2.5��1=2.5�����Դ��ǣ�CO2��g��+3H2��g��CH3OH��g��+H2O��l����H=��49.6kJ/mol��2.5����3����ͼ��֪����0��15h�ڣ�����������ͬʱ����CH4�����ߣ��Է�Ӧ��Ч����õĴ����Ǣ�
=2.5��1=2.5�����Դ��ǣ�CO2��g��+3H2��g��CH3OH��g��+H2O��l����H=��49.6kJ/mol��2.5����3����ͼ��֪����0��15h�ڣ�����������ͬʱ����CH4�����ߣ��Է�Ӧ��Ч����õĴ����Ǣ�
���Դ��ǣ���4����t1ʱ�̸ı�һ������������a��Ϊb�����̵���ƽ���ʱ�䣬��Ӧ���ʼӿ죬ƽ��ʱCO��Ũ�Ȳ��䣬�ı䲻Ӱ��ƽ���ƶ����������������¶ȣ���Ӧ���Ƿ�Ӧǰ����������ʵ�������ķ�Ӧ������ѹǿƽ�ⲻ�ƶ�����CO��Ũ�Ȼ������ܸı�������Ǽ������������t1ʱ�̣����������3L����ѹ����2L��ѹǿ����Ӧ���ʼӿ죬���̵���ƽ���ʱ�䣬��Ӱ��ƽ���ƶ���ƽ��ʱCO��Ũ�ȱ�Ϊ ![]() =0.45mol/L����t1ʱ��˲��CO��Ũ��Ϊ0.3mol/L�������仯����Ϊ��
=0.45mol/L����t1ʱ��˲��CO��Ũ��Ϊ0.3mol/L�������仯����Ϊ��  ��
��
���Դ��ǣ����������  ����5����BaSO4ת����BaCO3�����ӷ���ʽ��BaSO4��s��+CO32����aq��=BaCO3��s��+SO42����aq�����÷�Ӧ��ƽ�ⳣ��K=
����5����BaSO4ת����BaCO3�����ӷ���ʽ��BaSO4��s��+CO32����aq��=BaCO3��s��+SO42����aq�����÷�Ӧ��ƽ�ⳣ��K= 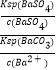 =
= ![]() =
= ![]() =0.044�����Դ��ǣ�BaSO4��s��+CO32����aq��=BaCO3��s��+SO42����aq����0.044��
=0.044�����Դ��ǣ�BaSO4��s��+CO32����aq��=BaCO3��s��+SO42����aq����0.044��
�����㾫�����������⣬������Ҫ�˽⻯ѧƽ��״̬���ʼ�����(��ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч��)����Ҫ���ջ�ѧƽ��ļ���(��Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%)�����֪ʶ���Ǵ���Ĺؼ���

 ������ȫ��������ϵ�д�
������ȫ��������ϵ�д�