��Ŀ����
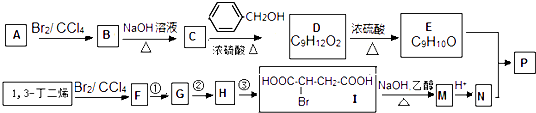
����Ŀ�������ȣ�SO2Cl2���������Ȼ������Ȼǻ������緼���廯������Ȼ���������Ȼ������������л�������������Ȼ���Ҳ��������ҩƷ��ȼ�ϡ�������Լ��ȣ�������ͨ��������Ϊ��ɫҺ�壬�۵�Ϊ��54.1�棬�е�Ϊ69.1�棬�ڳ�ʪ�������ס����̡���100�����ϱ㿪ʼ�ֽ�Ϊ�����������������ҵ�ϳ������������ϳ������ȣ�������Ķ��������������һ�������½��з�Ӧ���䷴Ӧԭ����ʵ��װ�����£�
SO2��g��+Cl2��g�� ![]() SO2Cl2��l����H=��97.3kJmol��1 ��ش��������⣺
SO2Cl2��l����H=��97.3kJmol��1 ��ش��������⣺
��1������A��������
��2�������B��ʢ�ŵ�ҩƷ�� �� ������
��3��ʵ��ʱ������C�зų�Һ��IJ���������
��4��װ������ʢ�ŵ�����Ϊ �� ��ȱ��װ���ң���ʵ������ʲôӰ�죿
��5���Ȼ��ᣨClSO3H����һ����ɫ�ķ���Һ�壬�д̼��Գ�ζ���е�178�棬���ȷֽ�Ҳ���Ƶ������ȣ�ͬʱ��������һ���������ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ �� �������ķ�����
A���ؽᾧ B������ C������ D����ȡ
��6��Ϊ��߱�ʵ���������ȵIJ��ʣ���ʵ���������Ҫע���������������ţ�
A.���������ٶȣ��������˿�
B.ˮԡ����������ƿ
C.��������ƿ���̣����ʵ����£�
���𰸡�
��1������������
��2����ʯ�ң�����δ��Ӧ�Ķ��������������Լ������е�ˮ����
��3����Һ©���Ͽڲ�����������ת����ʹҺ������
��4��Ũ��������Ͷ�������ˮ��Ӧ����HCl�����ᣬ�����������ȵIJ���
��5��2C1SO3H ![]() SO2Cl2+H2SO4Z������
SO2Cl2+H2SO4Z������
��6��C
���������⣺��1��������A�Ľṹ��������֪AΪ���������ܣ����Դ��ǣ����������ܣ���2������SO2Cl2�ڳ�ʪ�����С����̡���װ��B�����������տ�����ˮ������������δ��Ӧ�Ķ�����������������ֹ��Ⱦ����������ʢ�ż�ʯ�ң����Դ��ǣ���ʯ�ң�����δ��Ӧ�Ķ��������������Լ������е�ˮ��������3��������C�зų���Һ�IJ��������ǣ���Һ©���Ͽڲ�����������ת����ʹҺ�����£����Դ��ǣ���Һ©���Ͽڲ�����������ת����ʹҺ�����£���4����װ���Ʊ��������к���HCl��ˮ��������װ��ʢ�ű���ʳ��ˮ����ȥ���е�HCl����װ��ʢ��Ũ���ᣬ������������ȱ��װ���ң������Ͷ�������ˮ��Ӧ����HCl�����ᣬ��Ӧ����ʽΪ��Cl2+SO2+2H2O=2HCl+H2SO4���Ӷ������������ȵIJ��������Դ��ǣ�Ũ��������Ͷ�������ˮ��Ӧ����HCl�����ᣬ�����������ȵIJ�������5���Ȼ��ᣨClSO3H�����ȷֽ⣬Ҳ���Ƶ������ȣ�SO2Cl2��������һ�����ʣ���Ԫ���غ��֪���������ʺ���HԪ�أ�ClSO3H��S��Clԭ����Ŀ֮��Ϊ1��1����SO2Cl2��S��Clԭ����Ŀ֮��Ϊ1��2�������������к���SԪ�أ����ԭ���غ��֪��������ΪH2SO4 �� ��Ӧ����ʽΪ��2ClSO3H ![]() SO2Cl2+H2SO4 �� ����Ϊ����Һ�壬�е����ϴ�ȡ�����з��룬���Դ��ǣ�2ClSO3H
SO2Cl2+H2SO4 �� ����Ϊ����Һ�壬�е����ϴ�ȡ�����з��룬���Դ��ǣ�2ClSO3H ![]() SO2Cl2+H2SO4������6��Ϊ��߱�ʵ���������ȵIJ��ʣ����Կ����������٣��������˿죬ʹ���ַ�Ӧ������100������SO2Cl2��ʼ�ֽ⣬�÷�ӦΪ���ȷ�Ӧ�����Զ�������ƿ�����ʵ��Ľ��£����Դ��ǣ�AC��
SO2Cl2+H2SO4������6��Ϊ��߱�ʵ���������ȵIJ��ʣ����Կ����������٣��������˿죬ʹ���ַ�Ӧ������100������SO2Cl2��ʼ�ֽ⣬�÷�ӦΪ���ȷ�Ӧ�����Զ�������ƿ�����ʵ��Ľ��£����Դ��ǣ�AC��

 �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�����Ŀ���� 2L �ݻ�������ܱ������ڣ�800��ʱ��Ӧ 2NO��g��+O2��g���T2NO2��g����ϵ�У�n��NO����ʱ��ı仯���±���
t/s | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO��/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1����O2�ķ�Ӧ���ʱ�ʾ 0��2s �ڸ÷�Ӧ��ƽ����Ӧ���� v= �� ��������Ӧ��850���½��У���Ӧ2sʱ n��NO��=0.009mol�����Ҳ�����ʱ����ı䣬��÷�Ӧ���ȷ�Ӧ��
��2��ͼ�б�ʾNO2Ũ�ȱ仯��������������ĸ���� 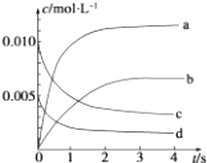
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����������ţ���
A.v��NO2��=2v��O2��
B.�����ڵ�ѹǿ���ֲ���
C.v����NO��=2v����O2��
D.�����������ܶȱ��ֲ���
��4����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����������ţ���
A.��ʱ�����NO2
B.�ʵ������¶�
C.����O2��Ũ��
D.ѡ���Ч������