题目内容
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H﹣1O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
B.充电时阳极反应为:Fe(OH)3﹣3e﹣+5 OH﹣═FeO ![]() +4H2O
+4H2O
C.放电时正极附近溶液的碱性增强
D.放电时负极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
【答案】A
【解析】解:A.放电时正极反应为FeO42+4H2O+3e﹣=Fe(OH)3+5OH﹣ , 每转移3mol电子,正极有1molK2FeO4被还原,故A错误; B.充电时阳极发生Fe(OH)3失电子的氧化反应,即反应为:Fe(OH)3﹣3e﹣+5OH﹣=FeO42﹣+4H2O,故B正确;
C.放电时正极反应为FeO42+4H2O+3e﹣=Fe(OH)3+5OH﹣ , 生成氢氧根离子,碱性要增强,故C正确;
D.根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn﹣2e﹣+2OH﹣=Zn(OH)2 , 故D正确.
故选A.
根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn﹣2e﹣+2OH﹣=Zn(OH)2 , 高铁酸钠在正极得到电子,电极反应式为FeO42+4H2O+3e﹣=Fe(OH)3+5OH﹣ , 根据电极反应式可判断电子转移的物质的量与反应物之间的关系,充电时,阳极上氢氧化铁转化成高铁酸钠,电极反应式为Fe(OH)3+5OH﹣=FeO42+4H2O+3e﹣ , 阳极消耗OH﹣离子,碱性要减弱,以此解答该题.

【题目】在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
t/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)用O2的反应速率表示 0~2s 内该反应的平均反应速率 v= . 若上述反应在850℃下进行,反应2s时 n(NO)=0.009mol,并且不再随时间而改变,则该反应是热反应.
(2)图中表示NO2浓度变化的曲线是(填字母). 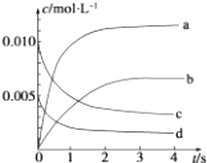
(3)能说明该反应已达到平衡状态的是(填序号).
A.v(NO2)=2v(O2)
B.容器内的压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是(填序号).
A.及时分离出NO2
B.适当升高温度
C.增大O2的浓度
D.选择高效催化剂.