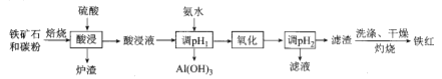
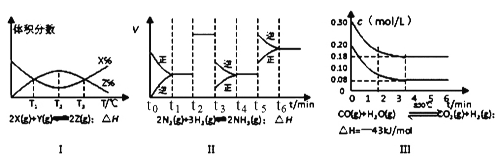题目内容
【题目】人体内的血红蛋白(Hb)和肌红蛋白(Mb)均可与O2结合,Hb也可以与CO结合。
已知:反应①:Hb(aq)+O2(g)![]() HbO2(aq) H1<0;
HbO2(aq) H1<0;
反应②:Hb(aq)+CO(g)![]() HbCO(aq) H2<0
HbCO(aq) H2<0
反应③:HbO2(aq)+CO(g)![]() HbCO(aq)+O2(g) H3
HbCO(aq)+O2(g) H3
(1)H3=_____(用H1、H2表示);反应③自发进行的趋势较大,则H1_____H2(填“>”、“<”或“=”)
(2)CO中毒者应立即转移至空气新鲜的地方,结合反应③,从平衡移动的原理分析这样做的理由是_____。
(3)肌红蛋白结合O2的化学方程式为Mb(aq)+O2(g) ![]() MbO2(aq) H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
MbO2(aq) H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
①对于CO中毒的病人,为解毒需要将v正提高到正常人的4倍,假设病人体内c(Mb)与常人相同,空气中p(O2)为20.0kPa,则解毒时提供病人呼吸的O2的压强是__________。
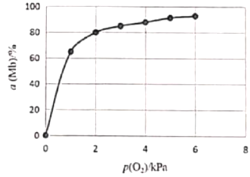
②该反应平衡总数的表达式为![]() ,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=_______,a(Mb)=________(用含p(O2)的式子表示)。
,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=_______,a(Mb)=________(用含p(O2)的式子表示)。
③ T℃时,![]() kPa-1,则T______37(填“>”、“<”或“=”),理由是________________。
kPa-1,则T______37(填“>”、“<”或“=”),理由是________________。
【答案】H2-H1 > 增大O2的浓度,减小CO的浓度,使平衡逆移 80.0kPa 2 kPa-1 2 kPa-1 ![]() >
> ![]() ,K(T℃)<K(37℃),该反应为放热反应,升温会使平衡常数减小
,K(T℃)<K(37℃),该反应为放热反应,升温会使平衡常数减小
【解析】
(1)根据盖斯定律,将②-①,整理可得③式;根据体系的自由能G=H-TS<0,反应能够自发进行判断;
(2)O2是生成物,增大生成物O2的浓度,可以使平衡逆向移动,也可以对CO进行稀释;
(3)①根据速率要求,结合速率常数只与温度有关分析;
②根据平衡常数的含义,结合37℃时,O2的平衡分压为20.0kPa,用三段式计算;
③结合正、逆反应速率的公式及可逆反应达到平衡时二者相等,再根据温度与反应热的关系判断。
(1)由于化学反应中的能量变化与反应途径无关,只与物质的始态和中态有关,根据盖斯定律,将②-①,整理可得③式,热化学方程式为:HbO2(aq)+CO(g)![]() HbCO(aq)+O2(g) H3=H2-H1;反应③自发进行的趋势较大,说明体系的自由能G=H-TS<0,该反应反应前后气体体积不变,则说明H3<0,由于H3=H2-H1;则H1>H2;
HbCO(aq)+O2(g) H3=H2-H1;反应③自发进行的趋势较大,说明体系的自由能G=H-TS<0,该反应反应前后气体体积不变,则说明H3<0,由于H3=H2-H1;则H1>H2;
(2)O2是生成物,增大生成物的浓度,平衡逆向移动,可以使血红蛋白与CO解离,就可以减轻人体的中毒症状;
(3)①对于CO中毒的病人,为解毒需要将v正提高到正常人的4倍,假设病人体内c(Mb)与常人相同,空气中p(O2)为20.0kPa,由于v正=kAc(Mb)p(O2),则速率为正常人的四倍,则氧气产生的压强也为原来的四倍,因此解毒时提供病人呼吸的O2的压强是4×20.0kPa=80.0kPa;
②假设开始时Mb的浓度为1,根据三段式
可逆反应 Mb(aq)+O2(g)![]() MbO2(aq)
MbO2(aq)
c(开始) 1 0
c(转化) a a
c(平衡) 1-a a
K=![]() ,根据空气中p(O2)为20.0kPa,此时a=80%,带入上式可得K=
,根据空气中p(O2)为20.0kPa,此时a=80%,带入上式可得K=![]() =2.0(kPa)-1;
=2.0(kPa)-1;
假设开始时Mb的浓度为1,根据三段式
可逆反应 Mb(aq)+O2(g)![]() MbO2(aq)
MbO2(aq)
c(开始) 1 0 0
c(转化) a p(O2) a
c(平衡) 1-a p(O2) a
K=![]() ,整理可a=
,整理可a=![]() ,由于该温度下平衡常数K=2,将K=2带入上式可得a=
,由于该温度下平衡常数K=2,将K=2带入上式可得a=![]() 。
。
③肌红蛋白结合O2的化学方程式为Mb(aq)+O2(g) ![]() MbO2(aq) ,H<0,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)当反应达到平衡时,v正= v逆,kAc(Mb)p(O2)= kDc(MbO2),则
MbO2(aq) ,H<0,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)当反应达到平衡时,v正= v逆,kAc(Mb)p(O2)= kDc(MbO2),则![]() ,在37℃时K=2.0(kPa)-1>-1(kPa)-1,说明平衡逆向移动,由于该反应的正反应为放热反应,根据平衡移动原理,升高温度,平衡向吸热的逆反应方向移动,使化学平衡常数降低,所以温度T>37℃。
,在37℃时K=2.0(kPa)-1>-1(kPa)-1,说明平衡逆向移动,由于该反应的正反应为放热反应,根据平衡移动原理,升高温度,平衡向吸热的逆反应方向移动,使化学平衡常数降低,所以温度T>37℃。

 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案